Vi nhân giống Bạch đàn lai Eucalyptus
(Eucalyptus benthamii x Eucalyptus dunnii).
Từ khóa: thiết lập nuôi cấy in vitro, môi trường nuôi cấy, nhân giống, BAP, NAA, GA3.
Gilvano Ebling Brondani1*, Leonardo Ferreira Dutra2, Ivar Wendling3*, Fernando Grossi1, Fabricio Augusto Hansel3 và Marla Alessandra Araujo4
1Bộ môn Khoa học Lâm nghiệp, Khoa Khoa học Nông nghiệp, Trường Universidade Federal do Paraná, Av. Lothario Meissner, 632, 80210-170, Curitiba, Paraná, Brazil.
2Tổng công ty nghiên cứu nông nghiệp Braxin - Embrapa, Pelotas, Rio Grande do Sul, Brazil. 3Trung tâm nghiên cứu lâm nghiệp quốc gia, Tổng công ty nghiên cứu nông nghiệp Braxin - Embrapa, Colombo, Paraná, Brazil.
4Bộ môn Khoa học Đất, Trường Universidade Federal de Lavras, Lavras, Minas Gerais, Brazil.
*Tác giả chính: E-mail: gebrondani@yahoo.com.br; ivar@cnpf.embrapa.br
DOI: 10.4025/actasciagron.v33i4.8317
TÓM TẮT:
Nghiên cứu này thiết lập qui trình vi nhân giống cây E. benthamii x E. dunnii, bằng việc thử nghiệm nồng độ chlorine cho việc khử trùng mẫu, nồng độ tối ưu của benzylaminopurine (BAP) và naphthaleneacetic acid (NAA) cho sự nhân chồi và tỷ lệ giữa BAP và gibberellic acid (GA3) trong hai môi trường dinh dưỡng để kéo dài chồi. Các đoạn đốt từ dòng H12, H19 và H20 được khử trùng với chlorine 0.5, 1.0, 1.5 và 2.0% (v/v). Các mẫu được cấy và phát triển trên môi trường ½MS bổ sung BAP (0, 0.25, 0.50, 0.75, 1.00 mg/L) và NAA (0, 0.025, 0.050, 0.075, 0.100 mg/L) để tạo chồi. Kéo dài các chồi trên môi trường MS và ½MS có bổ sung BAP (0, 0.05, 0.10 mg/L), GA3 (0, 0.1, 0.2, 0.3 mg/L). Sử dụng kết hợp 0.50 mg/L BAP và 0.050 mg/L NAA để tối ưu hóa việc nhân chồi tự dòng H12 và H20. Môi trường ½MS bổ sung GA3 tại nồng độ 0.10 mg/L trên dòng H12 và 0.20 mg/L trên dòng H20 kết hợp với 0.10 mg/L BAP cho kết quả kéo dài chồi tốt nhất. Cả hai dòng này có tỷ lệ ra rễ tháp trung bình 12.0% dưới điều kiện in vitro và 14.4% dưới điều kiện ex vitro.
GIỚI THIỆU
Có rất ít các loài hoặc giống Eucalyptus có tầm quan trọng về mặt kinh tế thích nghi được với điều kiện thời tiết khắc nghiệt, nhưng hai loài E. benthamii và E. dunnii lại có khả năng nổi bật trong việc thích nghi với thời tiết và tạo ra nguồn gỗ chất lượng. Ở những vùng sương giá gây ảnh hưởng nghiêm trọng đến sự hình thành và phát triển của cây Eucalyptus, đặc tính chịu lạnh là một đặc tính quan trọng và có thể được tạo ra bằng cách lai giống (BORÉM, 2007). Các loài Eucalyptus cũng thường diễn ra sự lai giống tự nhiên (BUTCHER và cộng sự., 2005). Gần đây, người ta đã tìm ra các giống Eucalyptus chống chịu sương giá tại rừng Embrapa Forests thuộc Colombo, Paraná State, đây là kết quả của việc lai tự phát giữa hai giống E. benthamii và E. dunnii. Các giống lai E. benthamii và E. dunnii là một giải pháp thay thế cho việc trồng cây gây rừng trong tương lai, đặc biệt vì khả năng chống chịu sương giá và nhiệt độ thấp (HIGA và cộng sự., 2000; JOVANOVIC và cộng sự., 2000). Tuy nhiên, có nhiều hạn chế trong quá trình tạo hạt giống, chủ yếu bởi vì giá thành cao và số lượng hạt giống lai sẵn có không nhiều. Hơn nữa, các dòng lai có tỷ lệ ra rễ thấp khi sử dụng các kỹ thuật nhân giống tự nhiên (macropropagation - nhân giống in vivo) như mini-cutting (BRONDANI và cộng sự., 2008; BRONDANI và cộng sự., 2010a, b). Vì vậy trước khi thương mại hóa các giống lai này, cần tiến hành nghiên cứu các phương pháp để thu được hạt và cây của chúng.
Một phương pháp sản xuất cây trồng là nhân giống in vitro (KOMATSU và cộng sự., 2011; MERKLE và NAIRN, 2005; NEHRA và cộng sự., 2005; VILLA và cộng sự., 2006; WATT và cộng sự., 2003), trong đó kỹ thuật vi nhân giống được sử dụng rộng rãi nhất, ứng dụng trong việc nhân giống cây trồng thân gỗ (BORÉM, 2007). Theo Joshi và cộng sự. (2003), kỹ thuật này liên quan đến các chương trình cải thiện nguồn gen nhằm tối ưu hóa hoặc duy trì vật liệu di truyền. Borém (2007) cho rằng quá trình vi nhân giống từ các phần cơ quan (như cảm ứng tạo chồi trực tiếp – phát sinh cơ quan trực tiếp hoặc kích thích các chồi sẵn có thông qua việc ngăn chặn hiện tượng trội đỉnh) là phương pháp được khuyến cáo nhất cho việc nhân giống cây trồng và cho kết quả biến dị di truyền thấp hơn các phương pháp khác.
Một vài nghiên cứu nuôi cấy in vitro loài Eucalyptus được thực hiện với một vài thay đổi trên môi trường dinh dưỡng MS (MURASHIGE; SKOOG, 1962), một loại môi trường được sử dụng rộng rãi nhất (AREZKI và cộng sự., 2000, 2001; BARRUETO CID và cộng sự., 1999; BENNETT và cộng sự., 1994; BUNN, 2005; BUNN và cộng sự., 2005; GLOCKE và cộng sự., 2006a, b; JOSHI và cộng sự., 2003; NUGENT và cộng sự., 2001; SHARMA và RAMAMURTHY, 2000). Có nhiều cơ chế kiểm soát quá trình ra rễ ngẫu nhiên (BALTIERRA và cộng sự., 2004; CORRÊA và cộng sự., 2005; FOGAÇA; FETT-NETO, 2005; TRINDADE; PAIS, 1997). Tuy nhiên, rất ít tác giả biết nhân giống vô tính cây Eucalyptus cận nhiệt đới, có thể sử dụng để trồng cây gây rừng dưới điều kiện khí hậu lạnh hơn.
Do không có một quy trình nuôi cấy in vitro các giống lai E. benthamii x E. dunnii, nghiên cứu này được thiết kế nhằm: (i) xác định nồng độ chlorine tốt nhất để khử trùng các đoạn đốt; (ii) xác định tỉ lệ benzylaminopurine (BAP) và NAF (NAA) tốt nhất để nhân chồi; (iii) xác định tỉ lệ BAP và gibberellic acid (GA3) tốt nhất cũng như điều kiện môi trường nuôi cấy cho quá trình kéo dài chồi. Một quy trình được phát triển để tối ưu hóa tỷ lệ ra rễ và sống sót của mẫu dưới điều kiện ex vitro.
VẬT LIỆU VÀ PHƯƠNG PHÁP
Vật liệu thực vật
Vật liệu sử dụng được thu từ những cành giâm mini của cây 1 năm tuổi, trồng tại Guarapuava Paraná State, Brazil. Ba dòng lai E. benthamii x E. dunnii tốt nhất (H12, H19 và H20) được nhân giống bằng các kỹ thuật giâm cành thông thường. Cành giâm 90 ngày tuổi, dài 15cm được trồng trong những máng xối chứa cát và phát triển trong một hệ thống thủy canh. Sau 20 ngày, tiến hành tỉa cành lần đầu tại vị trí 5cm tính từ rễ của cành giâm. Cây trồng được tưới nhỏ giọt dung dịch dinh dưỡng hàng ngày với dòng chảy 5L/m2.
Lấy và chuẩn bị mẫu
Một tuần trước khi lấy chồi để nhân giống, các gốc mini được phun thuốc thuốc diệt nấm Kumulus DF® với liều lượng 3g/L (p/v). Các chồi từ bộ mẫu thứ 13 được chuyển vào một túi nhựa chứa 1% dung dịch ascorbic acid (p/v). Trong phòng thí nghiệm, lá được loại bỏ và rửa mẫu với nước khử ion để làm sạch bụi bẩn và các mảnh nhỏ.
Chuẩn bị môi trường nuôi cấy và điều kiện in vitro
Chỉnh pH đạt 5.8 bằng HCl (0.1M) và NaOH (0.1M), bổ sung vào môi trường 250 mg/L PVP-40, BAP và NAA. Sau đó cho thêm 6g/L agar và đem hấp khử trùng tại 121oC (≈1.0kgf/cm2) trong 20 phút. Sau khi hấp, sử dụng bộ lọc một lần Millex-GP® với màng lọc vô trùng 0.22 μm để bổ sung GA3 vào môi trường. Mẫu cấy được nuôi trong phòng tại 25°C (±2°C), chu kì sáng 16h và cường độ sáng 40μmol/m2/s.
Thiết lập mẫu cấy
Cắt các đoạn đốt (với một cặp chồi nách) từ phần giữa của chồi với kích thước trung bình 1.5cm và loại bỏ lá, nhúng vào cồn 70% (v/v) trong 15 giây, rửa lại bằng nước khử ion đã hấp tiệt trùng, sau đó ngâm vào chlorine (NaOCl) nồng độ 0.5, 1.0, 1.5 và 2.0% (v/v) với Tween 20® (0.05% v/v) trong 10 phút. Cuối cùng, các đoạn đốt này được rửa lại 3 lần với nước khử ion đã hấp tiệt trùng và cấy vào ống nghiệm 7x3cm chứa 10ml môi trường MS có bổ sung 30g/L sucrose (Duchefa ®).
Sau 21 ngày, đánh giá tình trạng nhiễm nấm, khuẩn và sự oxi hóa. Số lượng lá và chồi, tổng chiều dài chồi được định lượng từ các mẫu đã cấy. Thí nghiệm được thực hiện theo mô hình khối ngẫu nhiên (3x4), với ba dòng (H12, H19 và H20), bốn nồng độ chloride (0.5, 1.0, 1.5 và 2.0%) và năm độ lặp lại, mỗi độ lặp lại bao gồm 5 mẫu.
Nhân chồi
Chồi với 3 đến 5 chồi con được cấy vào ống nghiệm 10x2cm chứa 10ml môi trường ½MS có bổ sung BAP 0.25, 0.50, 0.75 và 1.0 mg/L (Duchefa), NAA 0.025, 0.050, 0.075 và 0.100 mg/L (Duchefa), sucrose 15 g/L. Sau 30 ngày, mẫu được chuyền vào ống nghiệm mới chứa môi trường như trên.
Số lượng chồi phát triển trên mỗi mẫu được đếm sau 60 ngày cấy. Thí nghiệm được thực hiện theo mô hình khối ngẫu nhiên (2x5x5), 2 dòng thử nghiệm (H12 và H20), 5 nồng độ BAP kết hợp với 5 nồng độ NAA, và 5 độ lặp lại. Mỗi độ lặp lại gồm 5 mẫu.
Kéo dài chồi
Mẫu có 15 đến 20 chồi được chuyền vào bình cấy 7x6cm chứa 30 mL môi trường ½MS đã bổ sung 250 mg/L PVP-40 (Duchefa), 15 g/L sucrose, 6 g/L agar (Duchefa) và pH 5.8 trong 21 ngày. Sau đó, mẫu được cấy vào bình cùng kích thước chứa 30ml môi trường MS có 30g/L sucrose hoặc ½MS có 15 g/L sucrose, cả hai môi trường được bổ sung thêm 0.05 và 0.10 mg/L BAP; 0.1, 0.2 và 0.3mg/L GA3 (Duchefa); 0.5 mg/L NAA.
Số lượng chồi kéo dài và chiều dài chồi trung bình của mỗi mẫu được xác định sau 30 ngày cấy. Thí nghiệm được thực hiện theo mô hình khối ngẫu nhiên (2x2x3x4), thử nghiệm trên 2 dòng (H12 và H20), 2 môi trường nuôi cấy (MS và ½MS), 3 nồng độ BAP kết hợp với 4 nồng độ GA3 và 5 lần lặp lại, mỗi độ lặp gồm 5 mẫu.
Ra rễ in vitro
Các chồi của dòng H12 và H20 dài 1.5cm và có 1 cặp chồi con được cấy trong ống nghiệm 10x2cm chứa 10 mL môi trường ½MS có 15 g/L sucrose được bổ sung thêm 0.1g/L calcium pantotenate (Merck®), 0.1mg/L Biotin (Duchefa), 0.1g/L Mio innosytol (Duchefa®), 2mg/L IBA (indole-3- butyric acid) (Duchefa®) (LE ROUX; VAN STADEN, 1991). Tỷ lệ phần trăm cây ra rễ được xác định sau 30 ngày cấy.
Ra rễ ex vitro
Các chồi của dòng H12 và H20 dài 1.5cm và có 1 cặp chồi con được xử lý với IBA 1,000 mg/L (tỷ lệ alcohol:water là 1:1, v/v) và chuyền vào chậu compost (55cm3). Cơ chất được sử dụng là hỗn hợp tro trấu và giá thể vermiculite (tỷ lệ 1:1, v/v) trộn với 4kg/m3 Simple Superphosphate® (20% P2O5 và 14% S), 1.5 kg/m3 FTEBR12® (9% Zn, 3% Fe, 2% Mn, 0.1% Mo, 1.8% B và 0.8% Cu).
Các chồi này được đặt trong nhà kính khoảng 40 ngày, với thiết bị kiểm soát tự động độ ẩm (RH ≥ 80%) và nhiệt độ (T <30°C). Sau đó, chuyển các chậu này tới một nhà bóng râm (giảm 50% ánh sáng) để thích nghi với khí hậu trong 22 ngày. Hệ thống tưới theo giờ gồm 12 đầu phun nhỏ với áp suất 2,0 kg/cm2, và lưu lượng 144 L/giờ (2,4 L/phút), cứ mỗi 2 giờ hệ thống sẽ được mở tưới trong hai phút. Sau đó, tiếp tục chuyển các chậu này ra ngoài trời trong suốt 28 ngày để phát triển thành cây cứng cáp hơn. Hệ thống tưới với áp suất nước 2,0 kg/cm2 gồm 12 đầu phun nhỏ với lưu lượng 97 L/giờ, được bật ba lần một ngày trong 20 phút.
Sau 90 ngày, tỷ lệ phần trăm cây ra rễ được xác định. Thí nghiệm được thực hiện theo mô hình khối ngẫu nhiên (2x2), thử nghiệm 2 dòng (H12 và H20) với có hoặc không bổ sung IBA, 6 độ lặp lại và 5 mẫu/độ lặp.
Phân tích thống kê
Dữ liệu được phân tích với kiểm định Lilliefors (p<0.05) và phân tích phương sai (ANOVA với p<0.01 và p<0.05). Dữ liệu định lượng được so sánh bằng kiểm định Tukey (p<0.05) và phân tích hồi quy đa biến (p<0.01 và p<0.05).
KẾT QUẢ VÀ THẢO LUẬN
Thiết lập mẫu cấy
Không có sự tương quan nhiều giữa dòng nhân giống và nồng độ chlorine khi khử trừng mẫu. Tuy nhiên, các dòng lại có ảnh hưởng đáng kể đến tỷ lệ phần trăm nhiễm khuẩn (p <0,01), oxy hóa (p <0,05) và hình thành cây (p <0,01). H19 có 9% số cây nhiễm khuẩn, lớn hơn H12 (chỉ nhiễm 1%) và H20 (không có hiện tượng nhiễm khuẩn). Các dòng H20 không có sự oxy hóa và có khác biệt về mặt thống so với dòng H19 (có 6% mẫu bị oxy hóa). Dòng H12 không khác biệt về mặt thống kê so với các dòng khác, trung bình 3% mẫu bị oxy hóa (Bảng 1).
|
Bảng 1: Số liệu trung bình hiện tượng nhiễm khuẩn, oxi hóa và mẫu khử thành công của các dòng lai E. benthamii x E. dunnii sau 21 ngày cấy. |
|
Dòng |
Nhiễm khuẩna |
Mẫu bị oxi hóaa |
Khử mẫu thành cônga |
|
--------------------------- (%)--------------------------- |
|
H12 |
1.0 B ± 4.47 |
3.0 AB ± 7.33 |
45.0 B ± 14.01 |
|
H19 |
9.0 A ± 12.10 |
6.0 A ± 9.40 |
46.0 B ± 7.31 |
|
H20 |
0.0 B ± 0.00 |
0.0 B ± 0.00 |
66.0 A ± 11.62 |
Giá trị trung bình được theo sau bởi cùng 1 chữ cái không có khác biệt đáng kể theo kiểm định Tukey (p < 0.05).
adữ liệu được thể hiện dưới dạng: giá trị trung bình± độ lệch chuẩn |
Tỷ lệ mẫu khử thành công và sống sót của dòng H12 và H19 lần lượt là 45 và 46%. Dòng H20 cho tỷ lệ thành công cao nhất với 66% mẫu sống sót (Bảng 1). Từ các mẫu khử thành công, số lượng lá, số chồi và chiều dài trung bình của chồi không có khác biệt về mặt thống kê giữa các dòng, trung bình mỗi mẫu có 5 lá và 2 chồi với chiều dài chồi khoảng 0.7cm.
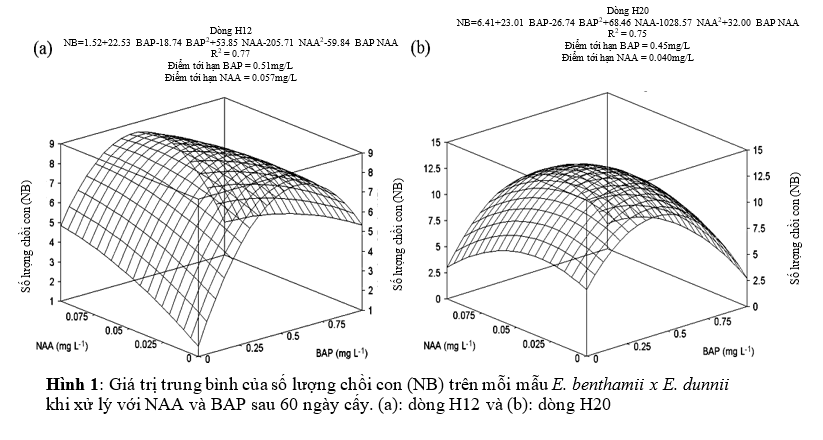
Nhân chồi
Mặc dù mẫu khử thành công, nhưng dòng H19 có tỷ lệ oxi hóa cao trong suốt quá trình tạo chồi con, do đó làm hạn chế khả năng nuôi cấy in vitro trong điều kiện thử nghiệm.
Nồng độ NAA và BAP ảnh hưởng đáng kể đến số lượng chồi con tạo ra của hai dòng H12 và H20 (p<0.01; Hình 1). Số lượng chồi cao nhất của dòng H12 có được khi sử dụng kết hợp 0.51 mg/L BAP và 0.057 mg/L NAA, kết quả cho ra 8.8 chồi con trên mỗi mẫu (Hình 1b).
Nồng độ trên 0.75 mg/L BAP không làm tăng số chồi con tạo ra.
Hơn nữa, sử dụng nồng độ <1mg/L BAP kết hợp với 0.1mg/L NAA mẫu sẽ có hiện tượng thủy tinh hóa, oxi hóa và chết.
Kéo dài chồi
Nồng độ môi trường và các chất điều hòa tăng trưởng ảnh hướng đáng kể đến số lượng chồi trên mỗi mẫu (Hình 2). Với môi trường ½MS, khi bổ sung thêm 0.11 mg/L BAP và 0.13 mg/L GA3, dòng H12 có số lượng chồi dài nhiều nhất đạt 10.6 chồi mỗi mẫu (Hình 2a). Còn dòng H20 có số chồi dài nhiều nhất là 5.82 chồi mỗi mẫu khi bổ sung 0.08 mg/L BAP và 0.22 mg/L GA3 (Hình 2b).
Mặc dù điểm tới hạn BAP ước tính thực tế của dòng H12 cao hơn nồng độ BAP cao nhất đã thử nghiệm trên môi trường ½MS (Hình 2a), nhưng nồng độ BAP 0.1mg/L cũng có tác động tích cực đến số lượng chồi dài, không phụ thuộc vào dòng. Tuy nhiên trên môi trường MS, trung bình dòng H12 có 2.58 chỗi dài mỗi mẫu khi sử dụng 0.07mg/L BAP kết hợp 0.11mg/L GA3 (Hình 2c).
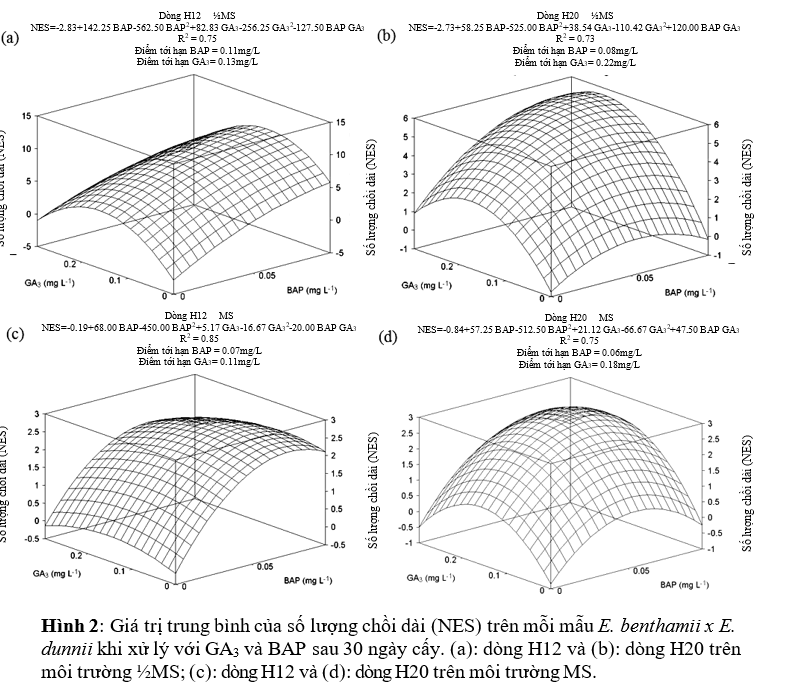
Dòng H20, với nồng độ 0.06mg/L BAP và 0.18mg/L GA3 cho 2.91 chồi (Hình 2d). Như vậy, khi phát triển trên môi trường MS với 0.1mg/L BAP các dòng cho ra 3 chồi dài trên mỗi mẫu.
Các dòng có những đáp ứng khác nhau với GA3. Không phụ thuộc vào môi trường, các dòng đều tạo nhiều chồi nhất khi bổ sung 0.1mg/L GA3 đối với H12 và 0.2mg/L GA3 đối với dòng H20. Hơn nữa, dòng H12 cho số chồi gần gấp đôi dòng H20 khi phát triển trên môi trường ½MS (Hình 2a và b).
Khi được phát triển trên môi trường MS, dòng H12 cho số lượng chồi giảm đi (thấp hơn 75%) so với mẫu cấy trên môi trường ½MS. Kết quả tương tự cũng xảy ra cho dòng H20, số lượng chồi mỗi mẫu giảm đi 50% khi phát triển trên môi trường MS. Hơn nữa, trên môi trường MS, mẫu cấy có hiện tượng bị oxi hóa, trong khi trên môi trường ½MS không diễn ra hiện tượng này.
Dòng H12 có chồi dài nhất (khoảng 1.52 cm) khi cấy trên môi tường ½ MS bổ sung 0.07 mg/L BAP và 0,2 mg/L GA3 (Hình 3a). Dòng H20 có chồi dài nhất (khoảng 1.5 cm) với môi trường ½ MS bổ sung 0.08 mg/L BAP và 0.21 mg mg/L GA3 (Hình 3b).
Khi sử dụng môi trường MS, dòng H12 cho chồi dài 1.13cm khi bổ sung 0.08 mg/L BAP và 0.16 mg/L GA3 (Hình 3c). Đối với dòng H20, các chồi dài nhất khi môi trường chứa 0.12 mg/L BAP và 0.30 mg/L GA3 (Hình 3d), giá trị trung bình là 1.43 cm.
Tóm lại, các chồi phát triển dài nhất trên môi trường bổ sung 0.10 mg/L BAP và 0.20 mg/L GA3 mà không phụ thuộc vào dòng và nồng độ MS. Nhưng cũng xuất hiện ngoại lệ với dòng H20 khi chồi dài nhất phát triển trên môi trường MS có nồng độ GA3 ở 0.30mg/L.
Ra rễ
Cả hai dòng H12 và H20 có tỷ lệ cây ra rễ là 12% trong điều kiện in vitro (dữ liệu không được thể hiện) sau 30 ngày cấy trên môi trường ½MS. Kết quả tạo rễ ex vitro đã xử lý với IBA cho thấy yếu tố di truyền của các dòng không ảnh hưởng đến tỷ lệ cây sống sót sau khi trồng trong nhà kính (41%), sau khi đưa vào nhà bóng râm (22.2%) và ra rễ dưới điều kiện ngoài trời (14.4%) (Bảng 2).
Cây trồng ra rễ đã khỏe mạnh và phát triển tốt trên mặt đất (Hình 2d). Mặc dù không có sự khác biệt đáng kể, nhưng dòng H12 có số liệu giá trị trung bình cao nhất (Bảng 2)
.
|
.Bảng 2: Số liệu trung bình của cây E. benthamii x E. dunnii sống sót sau khi ra nhà kính (GHS), nhà bóng râm (SHS) và ra rễ ngoài trời (ROC) sau 90 ngày trồng |
|
Dòng |
IBA (mg/L) |
GHSa |
SHSa |
ROCa |
|
--------------- (%)--------------- |
|
H12 |
0 (Đối chứngl) |
46.7 ± 08.17 |
25.0 ± 12.25 |
16.7 ± 07.53 |
|
1,000 |
43.3 ± 18.05 |
25.0 ± 21.68 |
18.3 ± 19.66 |
|
Trung bình |
45.0 |
25.0 |
17.5 |
|
H20 |
0 (Đối chứngl) |
38.7 ± 11.89 |
20.5 ± 26.69 |
12.6 ± 31.38 |
|
1,000 |
35.3 ± 09.56 |
18.2 ± 23.56 |
10.2 ± 27.88 |
|
Trung bình |
37.0 |
19.4 |
11.4 |
|
Trung bình tổng |
41.0 |
22.2 |
14.4 |
|
aDữ liệu thể hiện dưới dạng: Giá trị trung bình ± độ lệch chuẩn |
Tỷ lệ nhiễm nấm cao (trung bình 41.33%) ở tất cả các dòng. Việc xác định nguồn nhiễm (nấm và khuẩn) trong quá trình thiết lập mẫu cấy là rất quan trọng. Cần có các nghiên cứu sâu hơn về việc nhiễm nấm và khuẩn, sử dụng kết hợp các phương pháp giảm nhiễm với ứng dụng các sản phẩm trừ nấm và khuẩn trên cây giống trước khi thu chồi, để tối ưu hóa quá trình vi nhân giống cây lai.
Tỷ lệ phẩn trăm mẫu khử thành công trong nghiên cứu của chúng tôi cũng tương tự với các kết quả của Joshi và cộng sự. (2003) trên cây E. tereticornis x E. grandi 30 năm tuối, khoảng 50% mẫu sống sót sau khi thích nghi. Trong nghiên cứu này, 50% mẫu sống sau khi xử lý với NaOCl2 nồng độ 30% (v/v) trong 20 phút. Tương tự, Bennett và cộng sự. (1994) đã thực hiện khử mẫu trong 20 phút bằng sodium hypochlorite 1% (v/v) để khử các đoạn đốt 4 đến 5 năm tuổi của cây E. globulus.
George và cộng sự. (2008) nhấn mạnh rằng điều kiện sinh lý của cây mẹ dùng để lấy mẫu, có ảnh hưởng lớn đến các đáp ứng sau này của mẫu cấy. Trong thực tế đã có những ảnh hưởng liên quan đến việc đáp ứng theo dòng, bởi vì hệ thống quản lý vườn nhân giống mini đã cung cấp các điều kiện đồng nhất kiểm dịch thực vật. Do ảnh hưởng không đáng kể khi thử nghiệm các nồng độ sodium hypochlorite, nồng độ chlorine 0.5% được đề nghị sử dụng để khử mẫu của cây lai khi lấy mẫu từ một vườn nhân giống mini trong cát.
Việc vi nhân giống Eucalyptus có những đáp ứng khác nhau phụ thuộc vào nồng độ các chất điều hòa sinh trưởng va điều kiện làm việc. Gomes và Canhoto (2003) xác nhận rằng việc nồng độ 0.9μM BAP (≈ 0.20 mg/L) kết hợp với 0.05μM NAA (≈ 0.01 mg/L) trên môi trường ½MS là tối ưu cho việc nhân chồi con của cây E. nitens. Mặc dù có tỷ lệ nhân chồi thấp (2.25 chồi mỗi mẫu), kết quả của các tác giả này cũng hứa hẹn vì khả năng chống chịu cao của loài này. Joshi và cộng sự. (2003) đã nhận thấy rằng E. tereticornis x E. grandis tạo 20 đến 25 chồi mỗi mẫu sau 150 ngày trên môi trường MS medium có bổ sung 1mg/L BAP và 1 mg/L NAA.
Các kết quả tương tự cũng thu được bởi Bisht và cộng sự. (1999) đối với cây E. tereticornis x E. camaldulensis khi số chồi nhân cao nhất đạt được sau 120 ngày trên môi trường MS bổ sung 1mg/L BAP và 1mg/L NAA, không phân biệt dòng. Với cây E. tereticornis, Sharma và Ramamurthy (2000) thu được số lượng chồi lớn nhất (20 đến 30 chồi mỗi mẫu) trên môi trường MS bổ sung 1.0 mg/L BAP và 0.1 mg/L NAA.
George và cộng sự. (2008) nhấn mạnh rằng có quá nhiều cytokinin trong môi trường nuôi cấy có thể gây độc cho mẫu cấy, tạo các vấn đề nghiêm trọng trong các giai đoạn sau. Bisht và cộng sự. (1999) đã chứng minh rằng đối với E. tereticornis x E. camaldulensis nồng độ BAP cao nhất (>1mg/L) làm giảm số lượng chồi trên mỗi mẫu, không phụ thuộc vào các dòng đã nghiên cứu. Bennett và cộng sự (1994) ghi nhận rằng nồng độ BAP trên 2,5 μM (≈ 0,56 mg/L) trên môi trường MS làm giảm số lượng chồi con trung bình trên mỗi mẫu E. colulus, tương tự như kết quả trong nghiên cứu này của chúng tôi, nồng độ trên 0.5 mg/L BAP làm giảm số lượng chồi con sinh ra trên mỗi chồi (Hình 1). Từ những kết quả thực tế này, nồng độ >0,5 mg/L BAP nên sử dụng trong giai đoạn nhân chồi của các dòng cây lai này.
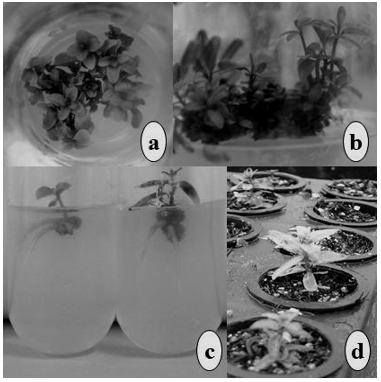
Hình 4. Vi nhân giống E. benthamii x E. dunnii. (a) chồi con phát triển, (b) kéo dài chồi, (c) ra rễ in vitro, (d) ra rễ ex vitro.
Nhìn chung, dòng H12 và H20 tạo số lượng chồi con tương ứng với nồng độ của chất điều hòa. Hơn nữa, khi kết hợp BAP 0.50 mg/L với NAA 0.05 mg/L cho kết quả hứa hẹn nhất khi làm tăng số lượng chồi trên mỗi mẫu, tương tự với các giá trị lớn nhất được ước tính theo các mô hình toán học, (Hình 4a).
Một số nghiên cứu đã sử dụng kết hợp cytokinin và gibberellin ở những nồng độ khác để kéo dài chồi, chủ yếu trên các mẫu thực vật khó nhân giống in vitro. Joshi và cộng sự. (2003) đã quan sát sự kéo dài chồi của cây lai E. tereticornis x E. grandis 30 năm tuổi sau khi nhân giống. Sau 30 ngày, các chồi có chiều dài từ 2,5 đến 3cm khi nuôi trên môi trường MS bổ sung 1mg/L BAP và 0.04 mg/L GA3.
Các kết quả tương tự cũng được tìm ra bởi Bisht và cộng sự. (1999) cho cây E. tereticornis x E. camaldulensis khi chồi được kéo dài sau 120 ngày trên môi trường MS bổ sung với BAP và NAA. Sau 180 ngày phát triển, tất cả các mẫu đều cho chồi có chiều dài từ 2.0 cm đến 3.5cm. Barrueto Cid và cộng sự. (1999) đã kéo dài những chồi tái sinh được từ các lá mầm trên môi trường SP (thay đổi dựa trên môi trường MS) được bổ sung 1.0 μM BAP (≈0.24 mg/L), 0.5 μM NAA (≈0.09 mg/L), 2.0 μM GA3 (≈0.7 mg/L), và sau 20 đến 30 ngày phát triển đã tạo những chồi khỏe mạnh với chiều dài trung bình 1.5 cm.
Nhìn chung, các mẫu đã cấy trên môi trường ½MS có bổ sung 0.10 mg/L BAP kết hợp 0.10 mg/L GA3 đối với dòng H12 và 0.10 mg/L BAP kết hợp 0.20 mg/L GA3 đối với dòng H20 cho số lượng chồi phát triển và chiều dài chồi tốt nhất, sau 30 ngày cấy kích thước chồi trung bình đạt 1.5cm và có các đặc điểm hình thái cũng như sức sống khỏe mạnh. Các chồi nhỏ và yếu tạo ra trên môi trường nuôi cấy có bổ sung GA3 mà không có BAP, đo đó công thức bổ sung này không nên áp dụng đối với các mẫu vật liệu cấy trong nghiên cứu này.
Hai dòng H12 và H20 có những đáp ứng giống nhau dưới điều kiện in vitro và ex vitro. Joshi và cộng sự. (2003) đã chứng minh tỷ lệ ra rễ cao nhất trên môi trường ½MS trong điều kiện in vitro. Tuy nhiên, việc tạo rễ diễn ra tối đa (75% ra rễ) khi bổ sung 1mg/L IBA, vì nồng độ >1 mg/L IBA thúc đẩy quá trình tạo mô sẹo. Bisht và cộng sự (1999) cũng có có kết quả tương tự khi tạo rễ tối đa với 1mg/L IBA trên môi trường MS trong điều kiện in vitro. Cần chú ý khi nghiên cứu các mẫu cây lai, với hàm lượng IBA 2mg/L sẽ gây cảm ứng tạo mô sẹo sau khi tạo rễ (Hình 4c), điều này đã được xác nhận trong nghiên cứu của Joshi và cộng sự. (2003), Bisht và cộng sự. (1999). Nồng độ IBA thấp hơn có thể làm tăng tỷ lệ ra rễ mà không gây cảm ứng tạo mô sẹo (Hình 4d).
Kiểu gen của những dòng lai này đã được chứng minh có tỷ lệ tạo rễ thấp, ngay cả khi nuôi cấy in vitro, kết quả cũng tương tự như nuôi cấy dưới điều kiện ex vitro. Điều này cho thấy rằng cây lai E. benthamii x E. dunnii có thể được nhân giống trực tiếp trong điều kiện ex vitro, do đó việc tối ưu hóa quá trình vi nhân giống đã được thử nghiệm. Mặc dù tỷ lệ ra rễ thấp thông qua quá trình vi nhân giống, các kết quả trong nghiên cứu này cũng có nhiều hứa hẹn vì các dòng lai này đã có sự tái sinh rễ khi tiến hành nhân giống in vivo (BRONDANI và cộng sự., 2008, 2010a, b). Các nghiên cứu sâu hơn sẽ cần thiết để bổ sung nhằm phát triển một quy trình vi nhân giống hiệu quả hơn cho các kiểu gen này.
KẾT LUẬN
Để khử trùng các đoạn đốt, nên sử dụng 0.5% Chlorine (NaOCl).
Kết hợp BAP 0.50 mg/L và NAA 0.05 mg/L trong môi trường ½MS tạo được số lượng chồi lớn nhất cho dòng H12 và H20. Nồng độ GA3 đối với dòng H12 là 0.10 mg/L và dòng H20 là 0.20 mg/L kết hợp với 0.10mg/L BAP trong môi trường ½MS, tạo được những chồi dài nhất.
GA3 ảnh hưởng đến sự kéo dài chồi phụ thuộc vào thành phần cơ bản của môi trường nuôi cấy, môi trường ½MS cho kết quả tốt nhất với những đặc điểm đã phân tích. Cả hai dòng H12 và H20 đều có tỷ lệ ra rễ thấp, trung bình 12% số cây ra rễ trong điều kiện in vitro và chỉ có 14,4% số cây ra rễ trong điều kiện ex vitro.
Lời cảm ơn
Chúng tôi xin gửi lời cám ơn đến Embrapa Florestas – CNPF, UFPR và CNPq vì tất cả những sự hỗ trợ.
TÀI LIỆU THAM KHẢO
AREZKI, O.; BOXUS, P.; KEVERS, C.; GASPAR, T. Hormonal control of proliferation in meristematic agglomerates of Eucalyptus camaldulensis Dehn. In Vitro Cellular and Developmental Biology – Plant, v. 36, n. 5, p. 398-401, 2000.
AREZKI, O.; BOXUS, P.; KEVERS, C.; GASPAR, T. Changes in peroxidase activity, and level of phenolic compounds during light-induced plantlet regeneration from Eucalyptus camaldulensis Dehn. nodes in vitro. Plant Growth Regulation, v. 33, n. 3, p. 215-219, 2001.
BALTIERRA, X. C.; MONTENEGRO, G.; GARCÍA, E. Ontogeny of in vitro rooting processes in Eucalyptus globulus. In Vitro Cellular and Developmental Biology – Plant, v. 40, n. 5, p. 499-503, 2004.
BARRUETO CID, L. P.; MACHADO, A. C. M. G.; CARVALHEIRA, S. B. R. C.; BRASILEIRO, A. C. M. Plant regeneration from seedling explants of Eucalyptus grandis x E. urophylla. Plant Cell, Tissue and Organ Culture, v. 56, n. 1, p. 17-23, 1999.
BENNETT, I. J.; McCOMB, J. A.; TONKIN, C. M.; McDAVID, D. A. J. Alternating cytokinins in multiplication media stimulates in vitro shoot growth and rooting of Eucalyptus globulus Labill. Annals of Botany, v. 74, n. 1, p. 53-58, 1994.
BISHT, P.; SHARMA, V. K.; JOSHI, I.; KAPOOR, M. L. Micropropagation of newly produced F1 hybrid of Eucalyptus (E. tereticornis Sm. x E. camaldulensis Dehn. Southern Form). Silvae Genetica, v. 48, n. 2, p. 104-108, 1999.
BORÉM, A. Biotecnologia florestal. Viçosa: Suprema, 2007.
BRONDANI, G. E.; WENDLING, I.; ARAUJO, M. A.; PIRES, P. P. Ácido indolbutírico em gel para o enraizamento de miniestacas de Eucalyptus benthamii Maiden & Cambage x Eucalyptus dunnii Maiden. Scientia Agraria, v. 9, n. 2, p. 153-158, 2008.
BRONDANI, G. E.; DUTRA, L. F.; GROSSI, F. G.; WENDLING, I.; HORNIG, J. Estabelecimento, multiplicação e alongamento in vitro de Eucalyptus benthamii Maiden & Cambage x Eucalyptus dunnii Maiden. Revista Árvore, v. 33, n. 1, p. 11-19, 2009.
BRONDANI, G. E.; GROSSI, F.; WENDLING, I.; DUTRA, L. F.; ARAUJO, M. A. Aplicação de IBA para o enraizamento de miniestacas de Eucalyptus benthamii Maiden & Cambage x Eucalyptus dunnii Maiden. Acta Scientiarum. Agronomy, v. 32, n. 4, p. 667-674, 2010a.
BRONDANI, G. E.; WENDLING, I.; GROSSI, F.; DUTRA, L. F.; ARAUJO, M. A. Miniestaquia de Eucalyptus benthamii × Eucalyptus dunnii: (II) sobrevivência e enraizamento de miniestacas em função das coletas e estações do ano. Ciência Florestal, v. 20, n. 3, p. 453-465, 2010b.
BUNN, E. Development of in vitro methods for ex situ conservation of Eucalyptus impensa, an endangered mallee from southwest Western Australia. Plant Cell, Tissue and Organ Culture, v. 83, n. 1, p. 97-102, 2005.
BUNN, E.; SENARATNA, T.; SIVASITHAMPARAM, K.; DIXON, K. W. In vitro propagation of Eucalyptus phylacis L. Johnson and K. Hill., a critically endangered relict from Western Australia. In Vitro Cellular and Developmental Biology – Plant, v. 41, n. 6, p. 812-815, 2005.
BUTCHER, P. A.; SKINNER, A. K.; GARDINER, C. A. Increased inbreeding and inter-species gene flow in remnant populations of the rare Eucalyptus benthamii. Conservation Genetics, v. 6, n. 2, p. 213-226, 2005.
CORRÊA, L. R.; PAIM, D. C.; SCHWAMBACH, J.; FETT-NETO, A. G. Carbohydrates as regulatory factors on the rooting of Eucalyptus saligna Smith and Eucalyptus globulus Labill. Plant Growth Regulation, v. 45, n. 1, p. 63-73, 2005.
FOGAÇA, C. M.; FETT-NETO, A. G. Role of auxin and its modulators in the adventitious rooting of Eucalyptus species differing in recalcitrance. Plant Growth Regulation, v. 45, n. 1, p. 1-10, 2005.
GEORGE, E. F.; HALL, M. A.; KLERK, G. J. Plant propagation by tissue culture. 3rd ed. The Netherlands: Springer, 2008. v. 1.
GLOCKE, P.; COLLINS, G.; SEDGLEY, M. 6-benzylamino purine stimulates in vitro shoot organogenesis in Eucalyptus erythronema, E. stricklandii and their interspecific hybrids. Scientia Horticulturae, v. 109, n. 4, p. 339-344, 2006a.
GLOCKE, P.; DELAPORTE, K.; COLLINS, G.; SEDGLEY, M. Micropropagation of juvenile tissue of Eucalyptus erythronema x Eucalyptus stricklandii cv. ‘Urrbrae Gem’. In Vitro Cellular and Developmental Biology – Plant, v. 42, n. 2, p. 139-143, 2006b.
GOMES, F.; CANHOTO, J. M. Micropropagation of Eucalyptus nitens Maiden (Shining Gum). In Vitro Cellular and Developmental Biology – Plant, v. 39, n. 3, p. 316-321, 2003.
HIGA, R. C. V.; HIGA, A. R.; TREVISAN, R.; SOUZA, M. V. R. Resistência e resiliência a geadas em Eucalyptus dunnii Maiden plantados em Campo Tenente, PR. Boletim de Pesquisa Florestal, n. 40, p. 67-76, 2000.
JOSHI, I.; BISHT, P.; SHARMA, V. K.; UNIYAL, D. P. In vitro clonal propagation of mature Eucalyptus F1 hybrid (Eucalyptus tereticornis Sm. x E. grandis Hill ex. Maiden). Silvae Genetica, v. 52, n. 3-4, p. 110-113, 2003.
JOVANOVIC, T.; ARNOLD, R.; BOOTH, T. Determining the climatic suitability of Eucalyptus dunnii for plantations in Australia, China and Central and South America. New Forests, v. 19, n. 3, p. 215-226, 2000.
KOMATSU, Y. H.; BATAGIN-PIOTTO, K. D.; BRONDANI, G. E.; GONÇALVES, A. N.; ALMEIDA, M. In vitro morphogenic response of leaf sheath of Phyllostachys bambusoides. Journal of Forestry Research, v. 22, n. 2, p. 209-215, 2011.
LE ROUX, J. J.; VAN STADEN, J. Micropropagation of Eucalyptus species. Journal of Hortscience, v. 26, n. 5, p. 199-200, 1991.
MERKLE, S. A.; NAIRN, C. J. Hardwood tree biotechnology. In Vitro Cellular and Developmental
Biology – Plant, v. 41, n. 5, p. 602-619, 2005.
MURASHIGE, T.; SKOOG, F. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum, v. 15, n. 3, p. 473-497, 1962.
NEHRA, N. S.; BECWAR, M. R.; ROTTMANN, W. H.; PEARSON, L.; CHOWDHURY, K.; CHANG, S.; WILDE, H. D.; KODRZYCKI, R. J.; ZHANG, C.; GAUSE, K. C.; PARKS, D. W.; HINCHEE, M. A. Forest biotechnology: innovative methods, emerging opportunities. In Vitro Cellular and Developmental Biology – Plant, v. 41, n. 6, p. 701-717, 2005.
NUGENT, G.; CHANDLER, S. F.; WHITEMAN, P.; STEVENSON, T. W. Adventitious bud induction in Eucalyptus globulus Labill. In Vitro Cellular and Developmental Biology – Plant, v. 37, n. 3, p. 388-391, 2001.
SHARMA, S. K.; RAMAMURTHY, V. Micropropagation of 4-year-old elite Eucalyptus tereticornis trees. Plant Cell Reports, v. 19, n. 5, p. 511-518, 2000.
TRINDADE, H.; PAIS, M. S. In vitro studies on Eucalyptus globulus rooting ability. In Vitro Cellular and Developmental Biology – Plant, v. 33, n. 1, p. 1-5, 1997.
VILLA, F.; PASQUAL, M.; PIO, L. A. S.; ASSIS, F. A. Multiplicação in vitro de porta-enxerto de videira em variações do meio MS. Acta Scientiarum. Agronomy, v. 28, n. 3, p. 345-349, 2006.
WATT, M. P.; BERJAK, P.; MAKHATHINI, A.; BLAKEWAY, F. In vitro field collection techniques for Eucalyptus micropropagation. Plant Cell, Tissue and Organ Culture, v. 75, n. 3, p. 233-240, 2003.
Phương Anh
SBC Scientific