Nhân giống cây tre bằng phương pháp nuôi cấy mô thực vật. Bằng cách đưa mẫu tre vào môi trường invitro để nhân chúng lên với số lượng lớn mà phương pháp truyền thông không đáp ứng được. Nhu cầu măng tre ăn được ngày càng tăng, do đó cần nhân chúng lên với số lượng đáng kể để đáp ứng nhu cầu đó. Giống tre Bambusa tulda và Melocanna baccifera
 Quy trình hiệu quả trong vi nhân giống của loài tre ăn được (Bambusa tulda và Melocanna baccifera) thông qua nuôi cấy nốt thân
Quy trình hiệu quả trong vi nhân giống của loài tre ăn được (Bambusa tulda và Melocanna baccifera) thông qua nuôi cấy nốt thân
Tóm tắt:
Nhu cầu cao của măng Bambusa tulda và Melocanna baccifera ở các dân tộc châu Á dẫn đến việc thâm canh cây tre. Để đạt việc này, tái sinh cây con in vitro là cần thiết vì chu kỳ hoa dài và bất thường dẫn đến khan hiếm hạt tre. Quy trình tái sinh cây con hiệu quả của Bambusa tulda và Melocanna baccifera từ đốt thân, sau đó xác nhận loài bằng việc sử dụng trình tự của vùng đệm trnL-F. Hiệu quả đánh thức chồi ngủ đạt được tại BAP 3mg/L trên môi trường MS. Quan trọng, kết hợp 2mg/L Kn với 3mg/L BAP cho hiệu quả phối hợp trong nhân chồi Bambusa tulda và Melocanna baccifera. Dưới điều kiện tối ưu trên môi trường ½ MS bổ sung 3mg/L IBA, 10mg/L coumarin, và 3% sucrose, cho nhiều thân rễ nâu sậm ở Bambusa tulda và nhiều rễ (81.67%, P<0.05, F=15.46) ở Melocanna baccifera trong vòng 30 ngày. Thiết lập quy trình và xác nhận của các loài ở mức độ phân tử sẽ giúp các loài liên quan trong nhóm măng tre ăn được thương mại để bảo tồn nguồn gen hạn chế và tăng năng suất.

1. Giới thiệu:
Nhu cầu tre tăng cao ở các nước châu Á do tiện ích của nó trong thủ công nghiệp, xây dựng, công nghiệp giấy, ngư nghiệp, và tiêu dùng [1,2]. Phần ăn được của cây tre được chứng minh và phân nhóm dựa vào tổng thành phần chất cyanua [3]. Như vậy nhu cầu măng tre ăn được ngày càng cao cùng với đặc tính dinh dưỡng đáng kể là Dendrocalamus hamiltonii [4–6], Chimonobambusa callosa, Bambusa tulda, và Melocanna baccifera[3]. Melocanna baccifera được tìm thấy mọc thưa thớt ở các thung lũng các bang Đông Bắc Ấn Độ như Manipur, Sikkim, Arunachal Pradesh, và Mizoram [7]. Giá thị trường của măng tre lên men loài Bambusa tulda và các loài khác ở Ấn Độ có giá khoảng 40 Rs. (US 0.66$) đến 50 Rs. (US 0.83$) một kí [8], và giá có thể hơn US 1.20$ khi đóng hộp và phơi khô. Bởi vì canh tác nương rẫy và đốt rừng, Melocanna baccifera mọc hạn chế ở khu vựa đồi và đối mặt với nguy cơ tuyệt chủng.
Không có bất kỳ quy trình in vitro thân củ Bambusa tulda được báo cáo, thêm vào đó, cũng không có báo cáo về vi nhân giống Melocanna baccifera. Vì vậy, cần phát triển các quy trình mới về tạo thân rễ với nguồn mẫu chồi, từ đó phát triển thành các lóng mới hoặc chồi dễ dàng hơn. Tái sinh chồi và rễ là những bước quan trọng trong vi nhân giống in vitro. Các nâng cao gần đây trong nuôi cấy mô khám phá hiệu ứng phối hợp của silicon và natri cloride trong thúc đẩy tái sinh chồi bất định trong Ajuga multiflora [10]. Tuy nhiên, các quy trình dựa vào phôi hợp tử (vd: mẫu từ mô hạt) của việc tái sinh cây tre con đã được phát triển [11-15]. Đầu tiên, hạn chế của phương pháp phôi hợp tử trong tái sinh cây tre con là các giao thức cho ra các giống riêng và do đó không được áp dụng cho các phương pháp chung. Thứ hai, thời gian ra hoa lâu và không thường xuyên, cũng như khả năng sống yếu và lượng hạt rất hạn chế [18, 19], thường gây hạn chế phương pháp phôi hợp tử trong tái sinh cây tre con. Vì vậy, các quy trình chính xác mới là yêu cầu trong nhân giống thành công của một số giống và mẫu đốt dễ dàng được tiến hành.
B. tulda và M. baccifera là các loài đơn giản với măng giàu dinh dưỡng [3, 20]. Quy trình tái sinh tạo cây con được phát triển cho B. tulda thông qua hạt [11] và mẫu đốt [21], không đạt được sự hình thành thân rễ( without achieving rhizogenesis). Đến nay, không có quy trình nào triển khai cho giống M. baccifera. Quy trình tái sinh cây con ở cây tre nói chung hạn chế do phân loại qua nhận dạng khó khăn và clonal fidelity (dòng thuần) của các giống đã báo cáo. Bởi vì các thất bại đó, các quy trình báo cáo trên một số giống tre cho tần số không tái sản xuất được (reproducible). Trong nghiên cứu này, chúng tôi lần đầu tiên sử dụng vùng đệm trnL-F để xác định vị trí chính xác của phân loại các loài được nghiên cứu. Thứ hai, chúng tôi phát triển một quy trình hiệu quả để nhân nhanh chồi in vitro từ chồi đốt và tạo rễ tối ưu cho B. tulda và M. baccifera.
2. Vật liệu và phương pháp nghiên cứu:
2.1. Vật liệu thực vật và nơi phát sinh loài. B. tulda và M. baccifera được xác định bởi các nhà thẫm quyền Botanical Survey of India (BSI), Kolkata. Nhánh bên của mẫu xác định được thu nhận từ lóng của B. tulda và M. baccifera ở vùng tọa độ 23o47’-25o41’ NL và 92o58’-94o47’ EL từ Sở Lâm nghiệp của tỉnh Imphal, Manipur, India trong suốt tháng 7/2011. Bộ DNA được cô lập và mô tả [22]. Số lượng và chất lượng DNA được kiểm tra trên quang phổ nanodrop (BioSpec-nano, Shimadzu, Japan) và tương ứng 0.8% w/v gel agarose điện di. Vùng đệm trnL-F được khuếch đại như mô tả trước đó [23] và đọc trình tự (sequenced). Trình tự được phân tích và chỉ thị phân tử loài dựa vào 98-100% trình tự tương ứng trên GenBank như accession: JX507132 (Bambusa tulda) và JX507133 (Melocanna baccifera). Các trình tự được liên kết sử dụng chương trình Muscle [24] và phiên bản thay thế tốt nhất được xác định dựa vào Akaike Information Criterion, điều chỉnh (AICc), và Bayesian Information Criterion (BIC). Phân tích phát sinh loài được trình bày sử dụng phương pháp khả năng tối đa trong phần mềm MEGA6 [25].
2.2. Mẫu và khử trùng bề mặt. Bẹ lá bao quanh phần đốt có chứa chồi bên (1.5-2 cm) được tách ra cẩn thận và lau với cồn 70% (v/v) tẩm trên bông vô trùng. Mẫu được khử trùng bề mặt trong 0.1% (v/v) dung dịch thủy ngân chloride (HgCl2) trong 15 phút và rửa 4 lần, mỗi lần rửa trong 5 phút. Mẫu vô trùng được nuôi cấy trên môi trường lỏng MS bổ sung 100mg/L myo inositol (Sigma, Saint Louis, MO, USA) và 30g/L sucrose. Giá trị pH được chỉnh đến 5.7±0.1 bằng NaOH 1N hay HCl 1N trước khi hấp vô trùng tại 121oC và 117.68 kPa trong 20’. Để đánh thức sự ngủ của chồi, môi trường MS bổ sung BAP tại các mức (1,2,3,4,5,6,7,8,9 và 10 mg/L).
2.3. Nhân nhanh chồi. Nhân nhanh chồi nách từ 3-5 cụm chồi được tách ra và chuyển sang môi trường MS bổ sung với (1) BAP tại 5 mức (1, 2, 3, 4 và 5 mg/L), (2) 6mg/L kinetin (Kn) đơn lẻ, hoặc (3) kết hợp Kn tại các nồng độ (1, 2, và 4 mg/L) với nồng độ tối ưu BAP 3mg/L. Điều đáng nói là việc chọn một nồng độ Kn 6mg/L là chọn lựa dựa trên các nghiên cứu trước kia (không có bảng số liệu). Nhân chồi được thực hiện từ 3-5 chồi nách được nuôi cấy, tách ra từ các cụm chồi. Nhân chồi trên môi trường lỏng được hỗ trợ bởi cầu nối giấy. Thông thường, chồi được chuyển định kỳ 10 ngày qua môi trường mới để ngăn hiện tượng oxi hóa phenol có thể làm chồi hóa vàng. Chồi được nhân trên mỗi môi trường nuôi cấy sau 45 ngày để đánh giá mức nhân nhanh của mẫu chồi nách.
2.4. Tiến trình tạo rễ. Chúng tôi sử dụng 5 mức (1, 2, 3, 4 và 5%) sucrose trong môi trường ½ MS để xác định nồng độ tối ưu để tạo rễ. Hơn nữa, rễ hình thành khi chuyển chồi từ thí nghiệm nhân nhanh sang môi trường ½ MS với 3% sucrose (tức là nồng độ tối ưu) và bổ sung các nồng độ chất điều hòa tăng trưởng khác nhau như sau. Cho B. tulda,chúng tôi sử dụng (1) 3mg/L IBA, (2) 3mg/L IBA với 10mg/L coumarin, và (3) 3mg/L IBA, 3mg/L IAA, và 10mg/L coumarin. Cho M. baccifera, chúng tôi sử dụng (1) 3mg/L IBA, (2) 3mg/L IBA với 10mg/L coumarin, (3) 3mg/L IBA, 0.05mg/L BAP và 10 mg/L coumarin. Tất cả nuôi cấy trong thí nghiệm để trong điều kiện phòng nuôi 25 ± 1oC với thời gian chiếu sáng là 16h, cường độ chiếu sáng là 45µmol/m2/s (PPF) cung cấp bởi ánh sáng đèn huỳnh quang (TLD Cool White 40W, Phillips, India). Phần trăm và số ngày ra rễ được ghi nhận. Sau quá trình tạo rễ, môi trường MS được làm sạch và cây con được trồng trong các hũ cao 76mm x đường kính 60 mm và chứa 143 ml đất đã hấp khử trùng. Thuần hóa ở 30±2oC và 84% ẩm độ trong nhà kính.
2.5. Kiểm tra dòng thuần (Clonal Fidelity test). Chúng tôi kiểm tra dòng thuần bằng giải trình tự vùng đệm trnL-F của cây con in vitro và so sánh với trình tự của cây mẹ.
2.6. Phân tích thống kê. Các thì nghiệm được lặp lại ba lần, tiến hành ở các thời điểm riêng biệt. Tất cả số liệu nhân chồi, tạo rễ in vitro được phân tích ANOVA một chiều kết hợp với Turkey’s post hoc test tại P≤0.05. Phân tích thống kê được thực hiện trên phần mềm thồng kê IBM SPSS v.19.0.
3. Kết quả thảo luận
3.1. Sự phát triển loài. Dựa vào trình tự vùng đệm tương tự giữa B. tulda, M. baccifera, và các loài có mối quan hệ gần gũi, khoảng cách trung bình giữa taxa (số nhiều của taxon-đơn vị phân loại) là 0.54. Tổng cộng 167 mẫu được tìm thấy của 1040 vị trí và 832 vị trí không đa hình (80.00%). Suy luận khả năng tối đa (maximum likelihood inference
– ML inference) được công nhận vị trí phân loại của B. tulda và M. baccifera có quan hệ đến phân loại mối quan hệ gần gũi (Hình 1). The ML inference xác nhận các loài được nghiên cứu khác nhau. Việc không xác định được chính xác các loài tre trước khi nhân giống có thể dẫn đến các báo cáo gây nhầm lẫn về các quy trình được phát triển. Động lực từ các thất bại để đạt được tái sinh cây con cho B.tulda dựa trên quy trình nuôi cấy nốt đầu tiên được báo cáo [21], và kể từ đó trở đi, chúng tôi nghi ngờ vấn đề này có thể là do các yếu tố như nhận diện loài, trạng thái sinh lý của cây mẹ, chất lượng các chất điều chỉnh tăng trưởng được sử dụng. Như tổng quan trong Mudoi et al. [16], những dòng vô tính nhận dạng kém, những dòng nhân bản vô tính, hoặc mẫu từ cây mẹ gây nguy hại cho mức chính xác của quy trình. Cân nhắc đặc tính của loài cho quy trình tái sinh cây con in vitro, chúng tôi đề nghị rằng quy trình có thể được xác nhận ở mức DNA để định danh cho mẫu như vậy hạn chế các tác nhân gây ảnh hưởng đến khả năng tái sản xuất. Không có sự khác biệt trong trình tự vùng đệm trnL-F giữa cây mẹ và cây con in vitro (không trình bày trong bảng số liệu). Vì vậy, xác nhận dòng thuần dựa vào quy trình phát triển.
3.2. Nuôi cấy và chồi ngủ bên in vitro. Các mẫu của B. tulda và M. baccifera được thiết lập thành công trên môi trường MS cải tiến với tỉ lệ nhiễm khuẩn thấp. Các thí nghiệm trước trong vi nhân giống của B. tulda từ mẫu đốt chồi đã thúc đẩy các vấn đề trong khởi đầu nuôi cấy vì các tác nhân nhiễm nấm [21]. Trong quy trình này, chúng tôi hạn chế tối đa khả năng nhiễm bằng cách tránh sử dụng nước để rửa trong bước đầu của việc khử trùng bề mặt. Thêm vào đó, việc đó cũng cho thấy bổ sung NaCl và silicon vào môi trường MS giúp tăng cường đáng kể hoạt tính kháng oxy hóa của enzyme [10] và cho thấy sự nhiễm như nhau trong nuôi cấy mô. Chồi nách phát triển sau 15 ngày từ chồi ngủ của B. tulda và M. baccifera. Tần số cao nhất của chồi ngủ quan sát thấy tại nồng độ tối ưu là 3mg/L BAP cho B. tulda và M. baccifera. Việc đó được đánh dấu bằng 1-3 chồi được hình thành tương tự với kết quả của chồi ngủ ở nách của B. tulda và M. baccifera (Hình 2).
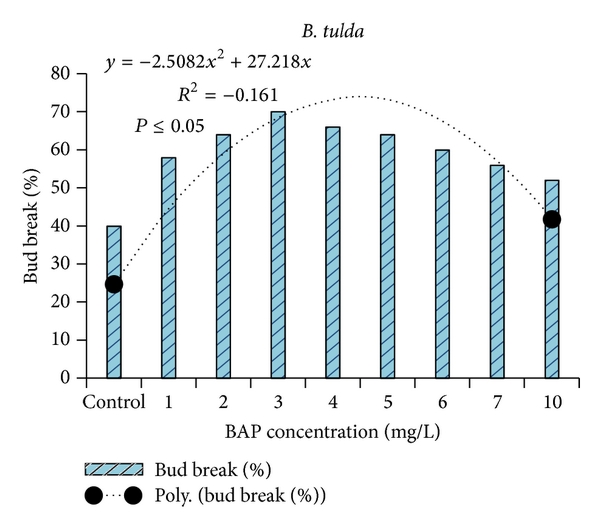
Như trình bày (hình 2), cao hoặc thấp hơn 3mg/L BAP đều cho mức tạo chồi ngủ thấp hơn. Chồi ngủ in vitro B. tulda và M. baccifera thấp trong môi trường muối cơ bản.
Mặc dù chúng tôi thử với các cytokinin khác như Kn, chỉ BAP mới cho hiệu quả trong thúc đẩy chồi ngủ tại các nồng độ đã thử. Trong các nghiên cứu trước đây, BAP được sử dụng thành công trong việc nảy chồi các giống như Arundinaria callosa, B. vulgaris, và Melocanna bambusoides [26–28] và trên các giống Origanum [29, 30]. Các nghiên cứu trước đây trên B. tulda thì không tìm hiểu ảnh hưởng của BAP lên chồi ngủ bên nách [21]. Tại nghiên cứu này, nảy nhanh chồi ngủ từ mẫu nách cho B. tulda và M. baccifera đạt được tại nồng độ 3mg/L BAP trong tương ứng 10 và 15 ngày. Chi tiết của chồi ngủ (bud break) (Hình 2, 3(a) và 4(a)), nhân chồi (Hình 3(b) và 4 (b)) và tạo rễ in vitro (Hình 3(c) và 4(C)) được mô tả cho B. tulda và M. baccifera.
3.3. Hiệu quả của BAP và Kn trong nhân chồi. Trong nghiên cứu này, có thể quan sát thấy sự tăng nồng độ BAP (2-4 mg/L) nâng cao tỷ lệ nhân chồi. Dù sao, trên 5mg/L BAP làm giảm mạnh tỉ lệ nhân chồi (Hình 3(b) và 4(b)). BAP cho thấy là chất điều hòa tăng trưởng thực vật hiệu quả cho nhân chồi in vitro cây tre [28, 31, 32]. Trong nghiên cứu của chúng tôi, tỉ lệ nhân chồi cao nhất trên một mẫu là 5.50 (P<0.05, F=3.18) với cây B. tulda dưới ảnh hưởng của 3mg/L BAP và 2mg/L Kn(Bảng 1). Cũng vậy, tỉ lệ nhân chồi tối đa trên một mẫu là 5.83 (P<0.05, F=3.85) ở cây M. baccifera dưới ảnh hưởng của 3mg/L BAP và 2mg/L Kn(Bảng 2). So ra, hiệu quả đơn lẻ của Kn lên B. tulda và M. baccifera không làm tăng tỉ lệ nhân chồi. Một sự thú vị, hiệu quả kết hợp của Kn và BAP làm tăng tỉ lệ nhân chồi cũng như chất lượng chồi trên B. tulda và M. baccifera (Hình 3(b) và 4(b)). Trong vấn đề này, hiệu quả kết hợp nồng độ là 2mg/L của Kn và 3mg/L BAP với số chồi trung bình trên một mẫu là 17.67 và 18.17 tương ứng trên B. tulda và M. baccifera.
Để đạt hệ số nhân chồi tối ưu, các tác giả khác đã kết hợp auxin nhân tạo (như 1-naphthalene acetic acid, NAA), auxin tự nhiên (như IBA) với cytokinin (như BAP) trong môi trường nuôi cấy [4, 27, 33]. Trong một số trường hợp, kết hợp BAP với kinetin nâng cao hệ số nhân chồi [14,34]. Trong nghiên cứu này, kết hợp BAP và kinetin cho hiệu quả phối hợp làm tăng việc nhân chối cùng như kết cấu chồi chuyển sang xanh đậm ở cả B.tulda và M. baccifera (Hình 3(b) và 4(b)). Ngược lại, Mishra et al. [21] đạt kết quả nhân chồi B.tulda khi kết hợp BAP, IBA và glutamine.


3.4. Tiến trình tạo rễ và hình thành thân củ. Cụm chồi 1-2 cm chuyển sang môi trường ½ MS tăng cường với các chất điều hòa tăng trưởng thực vật khác nhau để tạo rễ thành công. Thể hiện bởi phân tích hồi quy (Hình 5), các nồng độ khác nhau của sucrose phối hợp với 3mg/L IBA + 10mg/L coumarin ảnh hưởng đến phần trăm tạo rễ ở B.tulda và M. baccifera (Hình 5, Bảng 3). Tạo rễ tối ưu đạt được ở 3% sucrose. Trước đây, tại 3% sucrose chúng tôi đạt được khả năng tạo rễ tăng lên ở B.tulda và M. baccifera. Quan sát thấy rằng 3mg/L IBA + 3% sucrose thì tạo rễ trung bình 45.00% trong 76 ngày ở B.tulda. Thêm vào đó 10mg/L coumarin trong môi trường có bổ sung IBA làm tăng hiệu quả tạo rễ từ 45.00% lên 77.00% (Bảng 3). Một điều thú vị, việc hình thành thân rễ xảy ra trên môi trường nuôi cấy bổ sung 3mg/L IBA + 10mg/L coumarin + 3% sucrose ở B.tulda. Quan trọng, tỉ lệ tái sinh rễ cao nhất từ nốt thân rễ đạt ở 86.70 % trong 25 ngày trên môi trường MS bổ sung 3mg/L IBA + 3mg/L IAA + 10mg/L coumarin + 3% sucrose. B.tulda tạo thân rễ nâu sẫm và xuất hiện nhiều rễ trắng (Hình 3(c)). Hình thành thân rễ rất khó đạt được trong vi nhân giống in vitro trên loài tre. Dù sao, hình thái thân rễ tương tự đã được ở loài Dendrocalamus asper và D. membranaceus trong sự hiện diện của 3% sucrose trong môi trường MS. [35]. Một ghi chú có ý nghĩa nói rằng liều lượng duy nhất 3mg/L IBA + 3% sucrose cho mức tạo rễ thấp (55.00%, P<0.05, F=2.35) ở M. baccifera (Bảng 3). Không có sự hình thành rễ trong tất cả các nồng độ chất điều hòa tăng trưởng thực vật trên M. baccifera (Bảng 3). Trong nghiên cứu này, chúng tôi khai thác tiềm năng của sucrose, BAP, coumarin và IBA trong tạo rễ B.tulda và M. baccifera. Các tìm hiểu trược đây chứng minh rằng cảm ứng tạo rễ in vitro từ các cụm chồi ở cây tre trong các nghiệm thức đều yêu cầu có auxin dù riêng lẻ hay kết hợp với BAP hay coumarin [14, 2, 36-38]. Như những trình bày trong nghiên cứu này, coumatin yêu cầu trong thúc đẩy cảm ứng tạo rễ ở B.tulda và M. baccifera. Coumarin là hợp chất phenolic có thể hoạt động phối hợp với IBA để nâng cao sự giải phóng nội sinh của IAA trong mẫu trong suốt quá trình tạo rễ [39]. Giải phóng nội sinh IAA hỗ trợ cảm ứng tạo rễ nhanh hơn [39]. Cây con được thuần hóa thành công (Hình 3(d) và 4(d)) dưới điều kiện vườn ươm đạt tỉ lệ sống sót là 81.8% và 70.31% tương ứng với B.tulda và M. baccifera.


4. Kết luận:
Trong các quy trình được thiết lập, 3mg/L BAP được xác định là hiệu quả cho chồi ngủ và nhân chồi B.tulda và M. baccifera. Thân rễ trong vi nhân giống cây tre rất khó để đạt được và chưa được báo cáo trong các quy trình của B.tulda trước đây [11, 21]. Quy trình này phát triển thành công lần đầu tiên trong việc tạo thân rễ trên môi trường ½ MS bổ sung 3mg/L IBA, 10mg/L coumarin và 3% sucrose cho B.tulda. Nghiên cứu này cung cấp quy trình hiệu quả trong vi nhân giống B.tulda và M. baccifera từ mẫu đốt của đoạn thân trưởng thành. Quy trình này có thể giúp các bên liên quan thương mại hóa giống tre ăn được từ nguồn gen hạn chế và tăng năng suất.
Xung đột lợi ích
Các tác giả tuyên bố không có xung đột lợi ích về việc sự xuất bản của bài báo này.
Lời cảm ơn
Nghiên cứu này được sự hỗ trợ của Học viện Khoa học Phát triển Thế giới (TWAS), Trieste, Italy và Phòng Công nghệ sinh học, Chính phủ Ấn Độ (Chương trình số 3240223450).
Tài liệu tham khảo
Sayanika Devi Waikhom1,2 và Bengyella Louis1,3,4
1Institute of Bioresources and Sustainable Development, Takyelpat, Imphal, Manipur 795001, India
2Centre of Advanced Study in Life Sciences, Manipur University, Imphal, Manipur 795003, India
3Department of Biotechnology, The University of Burdwan, Golapbag More, West Bengal 713104, India
4 Department of Biochemistry, University of Yaounde I, BP 812, Yaounde, Cameroon
[1] J. M. O. Scurlock, D. C. Dayton, and B. Hames, “Bamboo: an overlooked biomass resource?” Biomass and Bioenergy, vol. 19, no. 4, pp. 229–244, 2000.
[2] L. M. Bal, P. Singhal, S. Satya, S. N. Naik, and A. Kar, “Bamboo shoot preservation for enhancing its business potential and local economy: a review,” Critical Reviews in Food Science and Nutrition, vol. 52, no. 9, pp. 804–814, 2012.
[3] S. D. Waikhom, B. Louis, C. K. Sharma et al., “Grappling the high altitude for safe edible bamboo shoots with rich nutritional attributes and escaping cyanogenic toxicity,” BioMed Research International, vol. 2013, Article ID 289285, 11 pages, 2013.
[4] R. K. Agnihotri and S. K. Nandi, “In vitro shoot cut: a high frequency multiplication and rooting method in the bamboo Dendrocalamus hamiltonii,” Biotechnology, vol. 8, no. 2, pp. 259–263, 2009.
[5] S. Sangita, W. Shivani, G. Mahesh, and S. Anil, “Nutritional characterization of shoots and other edible products of an edible bamboo—Dendrocalamus hamiltonii,” Current Research in Nutrition and Food Science, vol. 1, pp. 169–176, 2013.
[6] S. D. Waikhom, S. Ghosh, N. C. Talukdar, and S. S. Mandi, “Assessment of genetic diversity of landraces ofDendrocalamus hamiltonii using AFLP markers and association with biochemical traits,” Genetic and Molecular Research, vol. 11, no. 3, pp.2107–2121, 2012.
[7] H. B. Naithani, “Diversity of bamboo species in North East India,” in Ecology, Diversity and Conservation of Plants and Ecosystems in India, H. N. Pandey and S. K. Barik, Eds., pp. 312–322, New Dehli, India, 2006.
[8] P. K. Singh, S. P. Devi, K. K. Devi, D. S. Ningombam, and P. Athokpam, “Bambusa tulda Roxb. in Manipur State, India: exploring the local values and commercial implications,” Notulae Scientia Biologicae, vol. 2, no. 2, pp. 35–40, 2010.
[9] K. Tamura and M. Nei, “Estimation of the number of nucleotide substitutions in the control region of mitochondrial DNA in humans and chimpanzees,” Molecular Biology and Evolution,vol. 10, no. 3, pp. 512–526, 1993.
[10] I. Sivanesan and B. R. Jeong, “Silicon promotes adventitious shoot regeneration and enhances salinity tolerance of Ajuga multiflra Bunge by altering activity of antioxidant enzyme,” The Scientifi World Journal, vol. 2014, Article ID 521703, 10 pages,2014.
[11] S. Saxena, “In vitro propagation of the bamboo (Bambusa tulda Roxb.) through shoot proliferation,” Plant Cell Reports, vol. 9, no. 8, pp. 431–434, 1990.
[12] S. Arya and S. Sharma, “Micropropagation technology of Bambusa bambos through shoot proliferation,” Indian Forester, vol. 124, no. 9, pp. 725–731, 1998.
[13] P. Chowdhury, M. Das, S. R. Sikdar, and A. Pal, “Inflence of the physiological age and position of the nodal explants on micropropagation of fild-grown Dendrocalamus strictus nees,” Plant Cell Biotechnology and Molecular Biology, vol. 5, no. 1-2,pp. 45–50, 2004.
[14] F. Shirin and P. K. Rana, “In vitro plantlet regeneration from nodal explants of fild grown culms in Bambusa glaucescens Wild,” Plant Biotechnology Reports, vol. 1, pp. 141–147, 2007.
[15] D. Negi and S. Saxena, “In vitro propagation ofBambusa nutans Wall. ex Munro through axillary shoot proliferation,” Plant Biotechnology Reports, vol. 5, no. 1, pp. 35–43, 2011.
[16] K. M. Mudoi, P. S. Siddhartha, G. Adrita, G. Animesh, B. Debashisha, and B. Mina, “Micropropagation of important bamboos: a review,” African Journal of Biotechnology, vol. 12, no.20, pp. 2770–2785, 2013.
[17] W. S. Devi, B. Louis, and G. J. Sharma, “In vitro seed germination and micropropagation of edible Dendrocalamus giganteus munro using seeds,” Biotechnology, vol. 11, no. 2, pp. 74–80, 2012.
[18] D. H. Janzen, “Why bamboos wait so long to flwer,” Annual Review of Ecology and Systematics, vol. 7, pp. 347–391, 1976.
[19] S. D. Waikhom, L. Bengyella, R. Pranab, M. S. Wakambam, K. B. Pardeep, and C. T. Narayan, “Scanning electron microscopy of pollen structure throws light on resolving BambusaDendrocalamus complex: bamboo flwering evidence,” Plant Systematics and Evolution, vol. 299, article 10, 2013.
[20] C.-S. Lin, C. J. Liang, H. W. Hsaio, M. J. Lin, and W. C. Chang, “In vitro flwering of green and albino Dendrocalamus latiflrus,” New Forests, vol. 34, no. 2, pp. 177–186, 2007.
[21] Y. Mishra, P. K. Patel, S. Yadav, F. Shirin, and S. A. Ansari, “A micropropagation system for cloning of Bambusa tulda Roxb,” Scientia Horticulturae, vol. 115, no. 3, pp. 315–318, 2008.
[22] S. Aras, A. Duran, and G. Yenilmez, “Isolation of DNA for RAPD analysis from dry leaf material of some Hesperis L. specimens,” Plant Molecular Biology Reporter, vol. 21, no. 4, pp.461–462, 2003.
[23] P. Taberlet, L. Gielly, G. Pautou, and J. Bouvet, “Universal primers for amplifiation of three non-coding regions of chloroplast DNA,” Plant Molecular Biology, vol. 17, no. 5, pp. 1105–1109,1991.
[24] R. C. Edgar, “MUSCLE: multiple sequence alignment with high accuracy and high throughput,” Nucleic Acids Research, vol. 32, no. 5, pp. 1792–1797, 2004.
[25] K. Tamura, G. Stecher, D. Peterson, A. Filipski, and S. Kumar, “MEGA6: molecular evolutionary genetics analysis version 6. 0,” Molecular Biology and Evolution, vol. 30, pp. 2725–2729, 2013.
[26] W. S. Devi and G. J. Sharma, “In vitro propagation of Arundinaria callosa Munro-an edible bamboo from nodal explants of mature plants,” Th Open Plant Science Journal, vol. 3, pp. 35–39,2009.
[27] S. M. S. D. Ramanayake, V. N. Meemaduma, and T. E. Weerawardene, “In vitro shoot proliferation and enhancement of rooting for the large-scale propagation of yellow bamboo (Bambusa vulgaris “Striata”),” Scientia Horticulturae, vol. 110, no. 1, pp. 109–113, 2006.
[28] W. S. Devi and G. J. Sharma, “In vitro proliferation and enhancement of rooting in Melocanna bambusoides Trin. From nodal explants,” Journal of Bamboo and Rattan, vol. 8, no. 1-2,pp. 43–52, 2009.
[29] E. A. Oluk and A. C¸ akir, “Micropropagation of Origanum sipyleum L., an endemic medicinal herb of Turkey,” African Journal of Biotechnology, vol. 8, no. 21, pp. 5769–5772, 2009.
[30] M. U. Yildirim, “Micropropagation of Origanum acutidens (HAND.MAZZ.) IETSWAART using stem node explants,” The Scientifi World Journal, vol. 2013, Article ID 276464, 3 pages, 2013.
[31] S. Islam and M. M. Rahman, “Micro-cloning in commercially important six bamboo species for mass propagation and at a large scale,” Plant Tissue Culture and Biotechnology, vol. 15, no.2, pp. 103–111, 2005.
[32] R. Yasodha, S. Kamala, S. P. A. Kumar, P. D. Kumar, and K. Kalaiarasi, “Effct of glucose on in vitro rooting of mature plants of Bambusa nutans,” Scientia Horticulturae, vol. 116, no. 1, pp.113–116, 2008.
[33] I. D. Arya, P. K. Rana, R. Satsangi, F. S. Muzaffr, S. Sharma, and S. Arya, “Rapid and mass multiplication of bamboos through tissue culture techniques,” in Role of Plant Tissue Culture in Biodiversity Conservation and Economic Development, S. K. Nandi, L. M. S. Palni, and A. Kumar, Eds., pp. 29–39, Gyanodaya Prakashan, Nainital, India, 2002.
[34] M. Das and A. Pal, “In vitro regeneration of Bambusa balcooa Roxb.: factors affcting changes of morphogenetic competence in the axillary buds,” Plant Cell, Tissue and Organ Culture, vol. 81, no. 1, pp. 109–112, 2005.
[35] C. Nirmala, A. H. Ali, and T. Badal, “De novo organogenesis in the form of rhizome in Dendrocalamus asper and D. membranaceus,” Current Science, vol. 100, no. 4, pp. 468–470, 2011
[36] S. Arya, P. K. Rana, R. Sharma, and I. D. Arya, “Tissue culture technology for rapid multiplication ofDendrocalamus giganteus Munro,” Indian Forester, vol. 132, no. 3, pp. 345–357, 2006.
[37] A. Ndiaye, M. S. Diallo, D. Niang, and Y. K. Gassama-Dia, “In vitro regeneration of adult trees of Bambusa vulgaris,” African Journal of Biotechnology, vol. 5, no. 13, pp. 1245–1248, 2006.
[38] S. M. S. D. Ramanayake, K. M. M. N. Maddegoda, M. C. Vitharana, and G. D. G. Chaturani, “Root induction in three species of bamboo with diffrent rooting abilities,” Scientia Horticulturae, vol. 118, no. 3, pp. 270–273, 2008.
[39] K. Tartoura, A. Da Rocha, and S. Youssef, “Synergistic interaction between coumarin 1,2-benzopyrone and indole-3-butyric acid in stimulating adventitious root formation in Vigna radiata (L.) Wilczek cuttings: I. Endogenous free and conjugated IAA and basic isoperoxidases,” Plant Growth Regulation, vol. 42, no. 3, pp. 253–262, 2004
Trâm Anh
SBC Scientific
Hotline: 0945677929
Email: info@sbc-vietnam.com