Nuôi cấy mô trên cây thông trắng Pinus wallichiana.
Môi trường được sử dụng là Murashige and Skoog đã được chỉnh sửa phù hợp với cây thông, hoặc có thể sử dụng McCown Woody plant medium cho nghiên cứu.
Từ khoá: tissue culture, regeneration, Pinus wallichiana.
 Tóm tắt
Tóm tắt
Sự hình thành chồi nụ và sự biệt hóa tiếp theo của chúng thành các chồi non đã được quan sát thấy từ việc nuôi cấy những đoạn trụ dưới lá mầm (hypocotyl) và phôi của Pinus wallichiana. Các đoạn cắt hypocotyl được thu thập để tạo thành các chồi ở kỳ gian phân của mô sẹo. Phôi được nuôi cấy trên một môi trường bổ sung dinh dưỡng với NAA 0,1 ppm và tiếp tục nuôi cấy mô sẹo lần 2. Việc nuôi cấy mô sẹo lần 2 trên môi trường cơ bản có bổ sung BAP 1 ppm đã cho kết quả sự hình thành chồi. Các phôi cũng được kích ứng để hình thành rất nhiều chồi nụ dọc theo bề mặt của lá mầm và hypocotyl. Chồi nụ được cắt và chuyển sang một môi trường dinh dưỡng khác để hình thành chồi.
Minh hoạ : Cotyledons; Cotyledonary; Hypocoty
Giới thiệu
Việc áp dụng các kỹ thuật nuôi cấy mô đối với các vấn đề khác nhau của sinh học lâm nghiệp đã dẫn đến sự gia tăng gần đây về sự quan tâm đến việc nuôi cấy mô in vitro thực vật hạt trần. Có ít báo cáo về việc kiểm soát sự biệt hóa cơ quan trong việc nuôi cấy mô thực vật hạt trần. Các chồi nụ (BALL, 1950, ISIKA WA, 1973, 1974, KONAR, 1972, CAMPBELL và DURZAN, 1975) và các chồi bình thường (WINTON và HUHTINEN, 1976) được sản xuất từ các loài cây lá kim tương đối ít. Sự tái sinh của cây con đã được ghi nhận từ lá mầm của Pinus palustris (SOMMER et a., 1975), các đoạn hypocotyl của loài Picea glauca (CAMPBELL và DURZAN, 1975) và các phân đoạn chân lá mầm (cotyledonary) và mô sẹo lần 2 (thu được từ lá mầm) của Pseudotsuga menziesii (CHENG , 1975).
Trong bài báo này, chúng tôi báo cáo các môi trường nuôi cấy thành công mô sẹo liên tục và tái sinh các chồi từ hypocotyl, lá mầm và mô sẹo thu được từ phôi trưởng thành của Pinus wallichiana.
Vật liệu và Phương pháp
Hạt của Pinus wallichiana (được Viện bảo vệ thực vật Dehra Dun, Ấn Độ thu thập) được rửa sạch cetrimide 2%, rửa sạch và ngâm trong nước cất vô trùng trong 24 giờ. Sau đó, chúng được tiệt trùng bề mặt với nước clo trong 15 phút, sau đó được rửa sạch kỹ bằng nước cất vô trùng. Phôi vô trùng được cắt tỉa và đặt lên môi trường dinh dưỡng, đoạn hypocotyl cũng được cắt ra từ hạt, khử trùng bề mặt bằng nước clo trong 5 phút, rửa bằng nước cất vô trùng và nuôi cấy trên môi trường dinh dưỡng khác nhau.
Môi trường MURASHIGE và SKOOG'S (1962) đã được sửa đổi để tạo ra môi trường cơ bản cho nghiên cứu này. Nó chứa: NH4NO4, 200 mg/l; CaCl2. 2H20, 250 mg/l; KNO3, 1000 mg/l; KCI, 300 mg/l; Na2HP04 • H20, 30 mg/l; KI, 0,75 mg/l; MnS04 • H20, 10 mg/l; H3BO3, 4 mg/l; CuS04 • 5H20, 0,25 mg/l; ZnS04. 7H20, 4 mg/l; CoCl2. 6H20, 0,25 mg/l; Na2Mo04. 2H20, 0,25 mg/l; Na2EDTA, 37,3 mg/l; FeS04. 7H20, 27,8 mg/l; Thiamine HCl, 1 mg/l; Nicotinic acid, 0.1 mg/l; Pyridoxin HCl, 0,1 mg/l; Myo-inositol, 100 mg/l và sucrose, 20.000 mg/l.
Môi trường được làm đông đặc lại với 0,8% agar và pH được điều chỉnh đến 5,8. Để phù hợp với các yêu cầu, các chất bổ sung sau đây đã được thêm vào một mình hoặc kết hợp với môi trường cơ bản (BM) trước khi hấp: 2,4-dichlorophenoxyetic axit (2,4-D), axit naphthaleneacetic (NAA), 6-Furfurylaminopurine (Kn) , 6-Benzylaminopurine (BAP), và sữa dừa (CM). Đối với mỗi lần nghiên cứu, một bộ gồm 48 môi trường đã được thực hiện và mỗi bộ thí nghiệm được lặp lại ba lần. Các môi trường nuôi cấy được duy trì ở 25 ± 2 ° C dưới ánh sáng khuếch tán.
Quan sát
Những đoạn Hypocotyl được nuôi cấy trên BM cùng với nồng độ NAA khác nhau (0,1; 0,5; 1 và 3 ppm). Các mẫu mô nuôi cấy trên các môi trường này cho thấy sự gia tăng tổng thể về kích thước sau 3 ngày nuôi cấy. Ở 0,1 ppm, sự sinh sôi nảy nở rộng rãi đã được quan sát trong vòng 12 ngày. Mô sẹo màu xanh lá cây và nhỏ gọn. Nó có thể được nuôi cấy lần 2 và duy trì trên cùng một môi trường. Mô sẹo cũng được nhận thấy ở NAA 0,5 ppm nhưng sự phát triển không phải là quá nhiều như ở nồng độ 0,1 ppm. Sự gia tăng nồng độ NAA đã làm giảm dần cường độ tăng sinh. Các thí nghiệm nuôi cấy trên BM cùng với nồng độ khác nhau của BAP (0,1; 0,5; 1 và 3 ppm) cho thấy sự gia tăng tổng thể về kích thước trong vòng 12 ngày. Ở nồng độ 0,1 ppm, mô sẹo được ghi nhận ở tất cả môi trường trong vòng 24 ngày. Mô sẹo màu xanh lá cây và sự phát triển rất chậm. Tăng nồng độ BAP lên đến 0,5 ppm sự tăng trưởng diễn ra tốt hơn. Trên môi trường BM + 1 ppm BAP, sự tái sinh của chồi nụ ở kỳ gian phân của mô sẹo đã được quan sát thấy. Tỷ lệ tái sinh là rất thấp. Nồng độ cao hơn (3 ppm) chỉ hỗ trợ tăng sinh mô sẹo sinh trưởng.
Phôi trưởng thành cũng được cắt và nuôi cấy trên môi trường BM + 0,1 ppm NAA. Trên môi trường này lá mầm trở nên xanh sáng và dài gấp 5 lần trong 7 ngày. Phần rễ hoặc chết đi hoặc phình to lên tạo thành mô sẹo màu nâu đến đen như sự tăng trưởng. Sự hình thành mô sẹo được ghi nhận sau 12 ngày và sự phản biệt hóa hoàn toàn sau 3 tháng. Môi trường này được bổ sung thêm các nồng độ khác nhau của NH4NO3 (200, 600, 1000, 1400 mg/l) để xác định nồng độ có thể hỗ trợ tăng trưởng mô sẹo tối đa. Khi nồng độ tăng, sự phát triển mô sẹo đã giảm. Mô sẹo phát triển trên BM + 0,1 ppm NAA được tiếp tục nuôi cấy trên BM + 1 ppm BAP. Sau khoảng 30 ngày hình thành nụ chồi nụ(Hình 1A). Sự phát triển của chồi nụ là rất chậm. Những mô sẹo có chứa chồi nụ được chuyển sang môi trường MS + 2% Suc + 10% CM và trên môi trường này sự hình thành chồi được quan sát thấy (hình 1B).
Phôi được nuôi cấy trên BM cùng với BAP 1 ppm. Các phôi nuôi cấy cho thấy sự gia tăng về kích thước và sau 24 ngày, nhiều chồi nụ được biệt hóa dọc theo bề mặt hypocotyl (Hình 1C). Sau khi chuyển sang môi trường MS + 2% Suc + 10% CM dẫn đến sự hình thành chồi. Ở môi trường BM + 1 ppm BAP + 2 ppm NAA, lá mầm đã ngừng kéo dài, có mọng nước. Các lá mầm và hypocotyl hình thành mô sẹo nơi chúng tiếp xúc với môi trường. Các mô sẹo có màu xanh lá cây và nhỏ gọn và có thể tiếp tục được nuôi cấy lần 2 trên cùng một môi trường. Trong vòng 3 tuần, lá chính và chồi nụ đã có thể nhìn thấy rõ ràng dọc theo bề mặt của lá mầm và hypocotyls. Nếu phôi được duy trì trong 6 tuần trên cùng một môi trường, mô sẹo phát triển lớn trước đó đã hình thành những nụ. Chồi nụ được tách ra và nuôi cấy trên MS + 2% Suc + 10% CM. Những chồi nụ được biệt hóa thành các chồi và mô này khi tiếp xúc với môi trường dinh dưỡng được phản biệt hóa và hình thành mô sẹo (Hình 1 D).
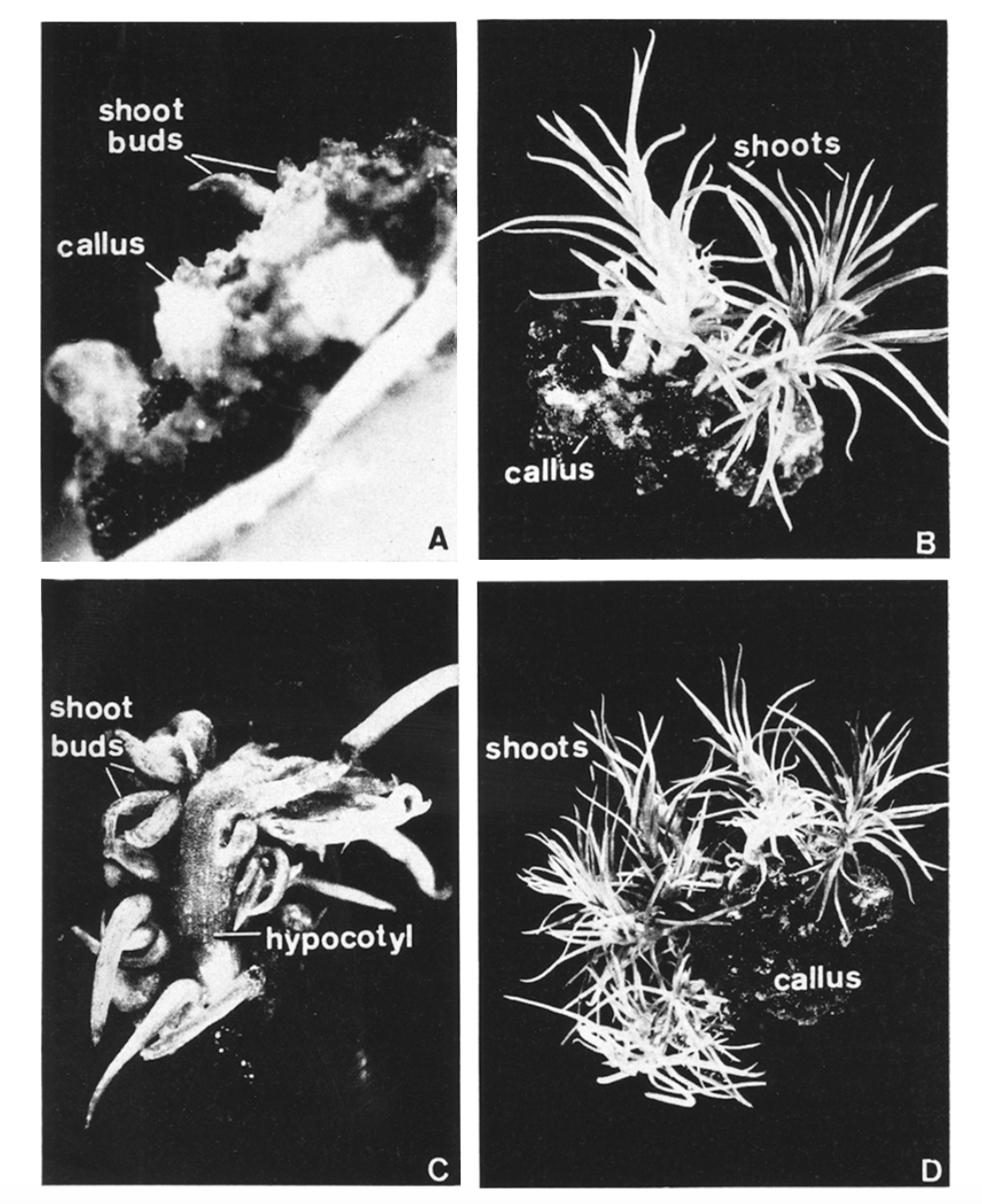
Hình. 1: A. Mẫu nuôi cấy 40 ngày trên môi trường BM + 1 ppm BAP cho thấy sự hình thành chồi nụ. X 3.2. B. Mẫu nuôi cấy 4 tháng tuổi trên MS + 2% Suc + 10% CM chuyển từ mẫu A cho thấy sự hình thành chồi. X 2. C. Mẫu 30 ngày nuôi cấy trên BM + 1 ppm BAP cho thấy sự hình thành chồi trên bề mặt hypocotyl. X 4. D. Mẫu nuôi cấy 4 tháng trên MS + 2% Suc + 10% CM chuyển từ môi trường BM + 1 ppm BAP + 2 ppm NAA. X 1.5.
Thảo luận và kết luận
Trong nghiên cứu này, có thể tiếp tục tăng sự phát triển mô sẹo từ những đoạn hypocotyl trên một môi trường rất đơn giản có chứa muối lượng rất thấp (BM) được bổ sung thêm NAA 0.1 ppm. Nồng độ NAA cao hơn đã ức chế sự tăng trưởng của mo sẹo. Sự thiết lập quá trình nuôi cấy mô sẹo từ các đoạn hypocoty của Pinus gerardiana cũng được báo cáo bởi KONAR (1975) nhưng môi trường nuôi cấy sử dụng khá phức tạp.
Nồng độ nitơ cao trong môi trường nuôi cấy như Murashige và Skoog rất thuận lợi cho sự phát triển nhanh chóng trong hầu hết các trường hợp. Để tìm nồng độ tối ưu của NH4N03 như là một nguồn nitơ, các nồng độ khác nhau của NH4N03 đã được kiểm tra. Các nồng độ này dao động từ 200 mg/l đến 1400 mg/l. Người ta phát hiện rằng nồng độ thấp nhất, tức là 200 mg/l làm sự nuôi cấy tăng trưởng nhanh hơn. Hầu hết các kết quả quan trọng và thú vị thu được trong khi cố gắng trong việc tạo ra cơ quan. Chồi nụ có thể được tạo ra trong mô sẹo lấy từ phôi. Để có sự biệt hóa hơn từ chồi nụ thành chồi, cần có nồng độ muối khoáng và sữa dừa cao hơn. Rễ tái sinh không được quan sát thấy. Phôi đã được tạo ra để hình thành chồi nụ và lá cây đầu tiên dọc theo bề mặt của lá mầm và hypocotyls bằng cách sử dụng các phương pháp tương tự với các chất được sử dụng bởi SOMMER và các đồng nghiệp (1975). Các nghiên cứu bổ sung đang được tiến hành để tối ưu hóa các điều kiện nuôi cấy từ đó có thể hình thành cây non hoàn chỉnh.
Tài liệu tham khảo
Department of Botany, University of Delhi, Delhi 110007, India
R. N. KONAR and M. N. SINGH
With 1 figure Received January 20, 1980 .
Accepted February 20, 1980
BALL, E.: Differentiation in a callus culture of Sequoia sempervirens. Growth 14, 295-325 (1950).
CAMPBELL, R. and D. DURZAN: Induction of multiple buds and needles in tissue cultures of Picea glauca. Can. J. Bot. 53, 1652-1657 (1975).
CHENG, T.: Adventitious bud formation in culture of Douglas-fir [Pseudotsuga menziesii (MIRB.) FRANCO]. Plant Sci. Lett. 5, 97-102 (1975).
ISIKAWA, H.: In vitro formation of adventitious buds and roots on the hypocotyl cultured of Cryptomeria japonica. Proc. 38th Annu. Meet. Bot. Soc. Japan, 57 (1973).
- In vitro formation of adventitious buds and roots on the hypocotyl of Cryptomeria japonica. Bot. Mag. Tokyo 87, 73-77 (1974). KONAR, R. N.: Tissue and cell cultures of pines and allied conifers. Final Tech. Rep. USDA, Project PL 480 (1972).
- In vitro studies on Pinus II. The growth and morphogenesis of cell cultures of Pinus gerardiana. Phytomorphology 25, 55-59 (1975).
MURASHIGE, T. and F. SKOOG: A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant. 15, 473-493 (1962). SOMMER, H., C. BROWN, and P. KORMANIK: Differentiation of plantlets in long leaf pine (Pinus palustris MILL.) tissue cultured in vitro. Bot. Gaz. 136, 196-200 (1975).
WINTON, L. and O. HUHTINEN: Tissue culture of trees. In Modern methods of forest genetics, 243-264. Springer-Verlag, Berlin, 1976.
R. N. KONAR, Department of Botany, University of Delhi, Delhi 110007, India.
Hiếu Minh
SBC Scientific
Hotline: 0945677929
Email: info@sbc-vietnam.com