Nuôi cấy mô trên cây cà phê nhằm đáp ứng nhu cầu về giống, tạo ra những giống có khả năng chống chịu tốt với thời tiết khắt nghiệt và kháng tốt với bệnh tật.Keywords: Batian, somatic embryo, Coffea arabica.
Giới thiệu giống cà phê Batian
Batian là giống cà phê thương mại ở Kenya trong năm 2010. Bệnh trên trái cà phê và vàng lá vốn là những bệnh chính trên café ở Kenya. Cùng với việc chín sớm, chất lượng tốt và năng suất cao, nhu cầu về cây trồng đã vượt quá cung. Các phương pháp nhân giống thông thường không đủ cung cấp cây giống, vì thế cần phát triển các phương pháp thay thế. Mục tiêu của đề tài này giúp xây dựng quy trình in vitro hiệu quả để nhân giống giống café Batian. Mẫu lá được thu và nuôi cấy trên môi trường Murashige và Skoog (MS) bổ sung nồng độ khác nhau của cytokinin benzyl amino purine (BAP) và thidiazuron (TDZ) riêng lẻ, 100mg/L myo-inositol 3% sucrose và làm đông môi trường với 0.3% gelrite. Kết quả cho thấy sự khác biệt trong việc hình thành phôi soma tùy theo các mức cytokinin. BAP tại 13.3µM cho kết quả tạo phôi cao nhất trên các mẫu, 6.06 ±1.18; và tỉ lệ phần trăm cao nhất của nuôi cấy phôi, 58.33%. Sự phát triển của phôi soma đạt được trên môi trường MS không bổ sung hormone với chiều dài 0.32±0.03 mm. Indole butyric acid tại 9.8 µM là tối ưu cho việc tạo và phát triển hệ thống rễ với chiều dài 1.22±0.09 mm. Quy trình này mở ra tiềm năng lớn mới trong nhân giống Batian trong 9 tháng.
Giới thiệu:
Café Kenya là loại chất lượng cao trên thế giới và góp phần đáng kể trong sự phát triển kinh tế quốc gia. Một trong những khó khăn của sản phẩm café ở Kenya là cây bị nhiễm bệnh. Trái café bệnh (Coffee berry disease – CBD) do Colletotrichum kahawae và bệnh vàng lá café ( coffee leaf rust – CLR) do Hemileia vastatrix là những bệnh nghiêm trọng trên cây café ảnh hưởng đến tính kinh tế ở Kenya (Gichuru et al., 2012). Chương trình quốc gia về trồng café cho kết quả trong việc tạo giống Batian trong năm 2010. Giống mới này có thể kháng cả CBD và CLR (Gichimu and Omodi, 2010). Việc tạo giống Batian nâng cao giá café dẫn đến áp đảo việc sử dụng cây giống tràn lan. Cùng với phương pháp nhân nhanh cây giống, nuôi cấy mô cung cấp lựa chọn khả thi cung cấp phương pháp nhân giống thông thường để giải quyết nhu cầu cao về giống cây này.
Phôi soma cho phép tạo và phát triển phôi từ mô soma không cần sự thụ tinh. Quá trình từ tế bào soma trải qua sự phát triển lưỡng cực để tăng số cây đồng nhất dy truyền trong 9 tháng. Có 2 cách tạo phôi soma; tạo phôi soma trực tiếp (direct somatic embryogenesis – DSE) , phôi có nguồn gốc trực tiếp từ mẫu;tạo phôi soma gián tiếp (indirrect somatic embryogenesis – ISE), phôi được bắt nguồn từ phản biệt hóa mô sẹo (Carneiro, 1999). Thời gian cần để tái sinh cây café con thông qua DSE thì thường ngắn hơn (9 tháng) cũng như khi so sánh thời gian khi sử dụng con đường ISE (12-13 tháng). Tuy nhiên, con đường tốn thời gian lại tạo ra nhiều và năng suất phôi / mẫu cao hơn. Ở Coffea sp., phôi soma lần đầu tiên được báo cáo bởi Staristky (1970) và sau đó, các quy trình tạo phôi soma được phát triển cho các kiểu gen khác nhau trên coffee (Yasuda et al., 1985; Hatanaka et al., 1991,1995; Sandra et al., 2000; Giridhar et al., 2004). Tài liệu này giúp cải thiện hiệu quả quy trình in vitro để nhân giống giống caffee Batian.
Vật liệu và phương pháp nghiên cứu
Địa điểm nghiên cứu và lấy mẫu
Nghiên cứu được tiến hành tại phòng thí nghiệm nuôi cấy mô thực vật của Tổ chức nghiên cứu café ở Ruiru (độ cao 1620m so với mực nước biển tọa độ 1o06’ Nam; 36o45’ Đông), Kenya. Cặp lá thứ ba được cắt từ cây mẹ lớn trong nhà kính ở Ruiru và để vào cốc có sẵn nước máy rồi đem vào phòng thí nghiệm để rửa sạch. Mẫu được rửa với nước máy có vài giọt dung dịch tẩy rửa teepol và rửa nước lại 5 lần. Mẫu được chuyển vào tủ cấy, ngâm cồn 70% (v/v) trong 30 giây và rửa lại hai lần với nước cất vô trùng. Sau đó mẫu được khử trùng bề mặt sử dụng dung dịch tẩy rửa thương mại (JIK) nồng độ 25%, chứa 3.85% natri hypochlorite trong 25 phút.
Chuẩn bị môi trường
Phát sinh trực tiếp phôi soma được tiến hành khi sử dụng môi trường muối cơ bản Murashige và Skoog (MS) bổ sung 30mg/L cysteine, 100mg/L inositol và 2% (w/v) sucrose. Môi trường được bổ sung các loại chất điều hòa tăng trưởng (PGR). Cytokinin được đánh giá riêng lẻ; benzyl amino purine (BAP) tại nồng độ 4.4, 8.8, 13.3, 17.7, 22.0 M và thidiazuron (TDZ) tại 4.5, 9.0, 13.6, 18.2, 22.7 uM. BAP tại 2.2, 4.4, 8.8, 13.3, 17.7, 22.0 uM được sử dụng cho môi trường phát triển. Mặc khác, môi trường ½ MS bổ sung auxin indole butyric acid (IBA) tại 4.9, 9.8, 19.7 uM và naphthalene acetic acid (NAA) tại 2.5, 5.3, 10.7 uM, và 100mg/L inositol và với 2% sucrose được sử dụng để tạo rễ. pH được chỉnh về 5.8 bằng NaOH 1N hoặc HCl 1N trước khi bổ sung agar sau đó đun và chia 10mL môi trường vào bình nuôi cấy. Môi trường được hấp khử trùng tại 1.06 kgcm-2 và 121oC trong 15 phút. Việc cấy chuyền được thực hiện trong tủ cấy. Mẫu lá được cắt thành mẫu 1cm2 và nuôi cấy trong môi trường MS để tạo phôi soma. Phôi soma được cắt và chuyển vào môi trường MS có cytokinin (BAP) để phát triển chồi, tiếp theo nuôi cấy trên môi trường MS có auxin IBA và NAA riêng lẻ để tạo rễ.
Thiết kế thí nghiệm, ghi nhận số liệu và phân tích thống kê
Thí nghiệm được bố trí hoàn toàn ngẫu nhiên (CRD). Trong thí nghiệm tạo phôi, mỗi nghiệm thức được lặp lại 3 lần với 48 mẫu cho mẫu lần lặp lại. Thí nghiệm cho sự phát triển phôi soma, mỗi nghiệm thức được lặp lại 3 lần với 30 mẫu trên mỗi lần lặp lại. Thí nghiệm tạo rễ, mỗi nghiệm thức được lặp lại 3 lần với 20 mẫu trên mỗi lần lặp lại. Số liệu về số phôi soma trên mỗi mẫu, phần trăm nuôi cấy phôi, chiều dài phôi cũng như chiều dài rễ được ghi nhận. Tất cả số liệu được phân tích phương sai 1 chiều (ANOVA) và sự khác biệt có nghĩa giữa các nghiệm thức được đánh giá bởi Duncan’s multiple test range (DMRT). Kết quả thể hiện gồm số liệu +-SE. Phần trăm (%) nuôi cấy mô được tính bằng tổng số mẫu có phôi/ tổng số mẫu nuôi cấy x 100, khi tỉ lệ phần trăm tạo rễ được tính bằng tổng số cây có rễ/ tổng số cây con nuôi cấy x100.
Kết quả
Phôi soma được quan sát từ mép cắt của lá sau 30 ngày nuôi cấy. Các giai đoạn tạo phôi soma được quan sát trong quá trình nuôi cấy (Hình 1). Những phôi soma sao khi phát triển sang giai đoạn lưỡng cực sau 90 ngày. Môi trường MS bổ sung BAP 8.8 M cho số phôi trên mẫu tốt nhất (6.06+-1.18) cũng như phần trăm nuôi cấy phôi cao nhất (58.33%). Phôi không tái sinh khi tăng nồng độ BAP từ 8.8 đến 22.0 uM (Bảng 1).
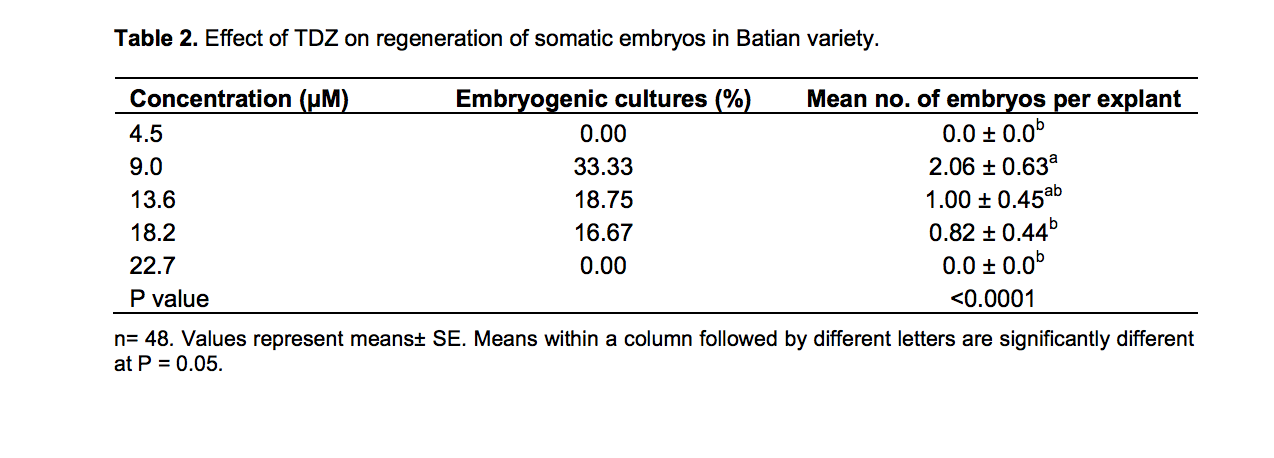
Môi trường MS bổ sung TDZ 9.0 uM cho kết quả có ý nghĩa cao nhất (2.06 +-0.63) về số phôi trên mẫu và phần trăm nuôi cấy phôi cao nhất (33.33%). Không có sự phản ứng khi tăng nồng độ TDZ từ 9.0 đến 22.7 uM (bảng 2).


Trên môi trường phát triển, phôi soma tăng về kích thước và tổng hợp sắc tố quang hợp (hình 2A). Các sắc tố này tạo điều kiện cho hoạt động quang hợp, tăng cường dự trữ như lipids, triglycerides, protein và các hydrates khác vốn hỗ trợ cho sự nảy mầm (Nasim et al., 2010). Phôi soma được xem xét về việc nảy mầm bởi sự phát triển và kéo dài của chồi (epicoty) với sự hiện diện của cấu trúc rễ mầm vốn là tiền thân của quá trình hình thành rễ (hình 2B). Trong nghiên cứu này, nuôi cấy phôi trên môi trường kéo dài phôi cho phản ứng bằng cách hình thành chồi, vì thế cần bước tạo rễ. Hiệu quả của BAP trong việc kéo dài phôi soma cho thấy không có sự khác biệt. Tuy nhiên, nghiệm thức đối chứng cho số liệu có nghĩa về chiều dài cao nhất là 0.27+-0.05 mm khi BAP tại 4.4 uM cho số liệu có nghĩa tuyệt đối về chiều dài thấp nhất (bảng 3).
Môi trường MS bổ sung với NAA 2.5 uM cho số liệu có nghĩa cao nhất về chiều dài rễ là 1.02+-0.14 mm và phần trăm cao nhất (66.67%) trong việc tạo rễ (bảng 4). Nồng độ auxin thấp thúc đẩy kéo dài rễ (hình 2C). Tăng nồng độ NAA từ 5.3 đến 10.7 uM cho kết quả ức chế sự kéo dài rễ (hình 2D).
Nuôi cấy phôi trên môi trường bổ sung 9.8 uM IBA cho số liệu có nghĩa cao nhất về chiều dài rễ, 1.22 +-0.09 mm. Tăng IBA từ 9.8 đến 19.7 uM cho thấy giảm phần trăm tạo rễ cũng như chiều dài rễ. Tương tự cho quan sát trong nuôi cấy phôi soma trên môi trường bổ sung NAA khi tăng nồng độ thì sự tạo rễ giảm (hình 2E). Mặc dù vậy, 9.8 uM IBA cho số liệu về chiều dài cao nhất cũng như phần trăm tạo rễ cao nhất (68.62%) (bảng 5).
Thảo luận
Tăng trưởng in vitro phụ thuộc nhiều vào sự tương tác giữa chất nội sinh tự nhiên và chất điều hòa tăng trưởng nhân tạo tương tự được thêm vào môi trường (George, 1993). Trong các nghiên cứu hiện nay, phôi soma chỉ hình thành ở mép cắt. Các kết quả cũng tương tự các kết quả của Hatanaka et al., 1991 đã báo cáo phôi soma chỉ hình thành ở mép cắt khi tương tác với môi trường có bổ sung chất điều hòa tăng trưởng. Họ đề nghị tạo vết cắt trên bề mặt (vết thương) để tăng khả năng hấp thu chất khoáng và chất điều hòa tăng trưởng nhằm tăng phần trăm nuôi cây phôi. Những kết quả cũng giống với Gatica et al. (2007) và Catie và Yasuda et al. (1985) đã công bố môi trường nuôi cấy bổ sung BAP nồng độ thấp cho kết quả tăng số phôi soma. Nó cũng ngược lài với kết quả của Ysuda et al. (1985) khi đã quan sát thấy môi trường bổ sung 4- mg/L BAP cho hiệu quả tạo phôi soma cao hơn của giống lai F1 Coffea arabica. Sự khác biệt này có thể giải thích bởi ảnh hưởng của bộ gen và các điều kiện chi tiết khác nên không có sự sao chép giữa hai nghiên cứu.
TDZ chủ yếu sử dụng như chất làm rụng lá (Giridhar et al., 2004) nhưng cũng như là một chất điều hòa tăng trưởng trong hệ thống nuôi cấy mô. Ở đậu phộng và lựu, TDZ có hiệu quả thay thế cho nhu cầu auxin và/hay cytokinin trong tạo phôi soma (Gill and Saxena, 1993). Trong nghiên cứu này, kết quả cho thấy TDZ tại 9.0 M cho tần số nuôi cấy phôi cao nhất (33%). Tuy nhiên, những kết quả này cũng ngược lại với kết quả của Kahia (1999) đã báo cáo là 100% khi mẫu lá café của Ruiru 11, giống lai F1 được nuôi cấy trên môi trường MS cải tiến bổ sung TDZ 1 M, và Gill and Saxena (1993) đã báo cáo 100% mẫu lá Nicotiana tabacum L. tạo phôi soma khi sử dụng TDZ. Trong nghiên cứu này, sử dụng TDZ trong hình thành phôi soma đạt được ở nồng độ thấp. Báo cáo của Giridhar et al. (2004) cũng cho kết quả tương tự, TDZ mức thấp kích thích tạo phôi soma trực tiếp trên Coffea.
Thời gian để tái sinh cây con qua DSE thường ngắn (9 tháng) khi so với ISE (12-13 tháng) (Ducos et al., 2010; Etienne et al., 2010). Phương pháp hai bước này cũng cho tần số phôi soma cao (HFSE) tương tự. Mặc khác, cách tốn thời gian cho kết quả nhiều và năng suất phôi/mẫu cao hơn. Bởi vì quá trình kéo dài, nuôi cấy trong môi trường có chất điều hòa tăng trưởng, sự thay đổi đa dạng dòng soma trong ISE cao hơn. Quy trình phát triển trong nghiên cứu này đảm bảo sản lượng đúng với kiểu cây con.
Auxin kích thích khởi tạo rễ vì kích hoạt vùng tế bào tăng trưởng tĩnh (quiescent pericycle cells) để khởi động phân chia và mở rộng giúp tạo điều kiện cho việc tạo rễ sau này, mặc dù phản ứng khác nhau ở các nồng độ (Fukaki and Tasaka, 2009). Taiz và Zegler, (2003) báo cáo sự cần thiết của auxin trong tạo rễ, tuy nhiên, sự phát triển rễ bị ức chế khi tăng nồng độ auxin. Kollmeier et al., (2000) tuyên bố nồng độ auxin cao ức chế kéo dài rễ. Riov và Yang (1989) cũng báo cáo rằng auxin làm tăng mức sinh tổng hợp ethylene. Sau đó, có thể thấy được nồng độ cao của NAA và IBA làm sinh tổng hợp ethylene gây ức chế kéo dài rễ. IBA được chứng minh là tốt hơn NAA trong hình thành rễ thông qua đánh giá các nồng độ.
Nhìn chung, hiệu quả của mỗi PGR trong các giai đoạn tái sinh của giống C.arabica chịu ảnh hưởng bởi nồng độ. Trong nghiên cứu này, quy trình tái sản xuất phôi soma để tái sinh Batian trong 9 tháng được phát triển. Quy trình có liên quan tới nuôi cấy mẫu lá trên môi trường ½ MS bổ sung 13.3 uM BAP. Phôi soma kéo dài trên môi trường MS không có hormon. Phôi soma tạo rễ trên môi trường MS bổ sung 19.7 uM IBA.
Lời cảm ơn
Các tác giả cảm ơn Tổ chức nghiên cứu Coffee (CRF) đã cung cấp kinh phí để tiến hành nghiên cứu. Công bố này được xuất bản với sự cho phép của chủ nhiệm đề tài .
Tài liệu tham khảo
Lubabali, A. H. 1*, Alakonya, A. E. 2, Gichuru, E. K. 1, Kahia, J. W. 3 and Mayoli, R. N. 1
1 Coffee Research Foudation, P.O. Box 4-00232, Ruiru, Kenya.
2 Jomo Kenyatta University of Agriculture and Technology, P.O. Box 62000-00200, Nairobi, Kenya.
3 World Agroforestry Centre (ICRAF), Cote d’ Ivoire Country Program Cocody Mermoz, 08 BP 2823, Abidjan, Côte d’ Ivoire.
Carneiro MF (1999). Advances in coffee biotechnology. AgBiotechNet. 1:1.
Ducos JP, Gibault E, Broun P, Lambot C (2010), Coffee Propagation by somatic embryogenesis at Nestle R&D Center-Tour. In: Park YS, Bonga JM, Park SY, Moon HK (eds.). Proceedings of the IUFRO working party 2.09.02: “Somatic embtyogenesis of trees” conference on “Advances in somatic enbryogenensis of tree and its application for future forests and plantations”, August 19-21, 2010, Suwon, Republic of Korea.
Fukaki H, Tasaka M (2009), Hormon interactions during lateral root formation. Plant Mol. Bio. 69:437-449.
Etienne H, Bertrand B, Ribas A, Lashermes P, Malo E, Montagnon C, Alpizar E, Bobadilla R, Simpson J, Dechamp E, Jourdan I, Georget F (2010). Current applications of coffee (Coffee arabica) somatic embryogenesis for industrial propagation of elite heterozygous materials in Central America and Mexico. In: Park YS, Bonga JM, Park SY, Moon HK (eds.). Proceedings of the IUFRO working party 2.09.02: “Somatic embtyogenesis of trees” conference on “Advances in somatic enbryogenensis of tree and its application for future forests and plantations”, August 19-21, 2010, Suwon, Republic of Korea…
Gatica AM, Griselda A, Espinoza AM (2007). Comparison of three in vitro protocols for direct somatic embryogenesis and plant regeneration of Coffea arabica L. cvs. Caturra e Catuai. Agronomia Costarricense 31(1): 85-94
Gichuru EK, John MI, Maria CS, Ana PP, Vitor MP, Varzea (2012). Addition physiological races of coffe leaf rust ( Hemileia vastatrix) identified in Kenya. Trop. Plant Pathol. 37(6):424
Giridhar P, Vino D, Indu EP, Ravishankar GA, Arun C (2004). Thidiazuron Induced Somatic Embryogenesis in Coffea arabica L. And Coffea Canephora P Ex Fr. Act. Bot. Croat. 63(1):25-33.
Hatanaka T, Arawaka O, Yasuda T, Uchida N, Yamaguch T (1991). Effect of plant growth regulators on somatic embryogenesis in leaf cultures of Coffea canephora. Plant Cell Rep. 10:179-182
Kahia WJ (1999). In vitro propagation of the Disease resistant cultivar –Ruiru 11. PhD thesis. University of London.
Kollmeier M, Felle HH, Horst WJ (2000). Is basipetal auxin flow involved in inhibition of root elongation. Plant Physiol. 122:945-956.
Nasim SA, Mujib AR, Kapoor SF, Aslam J, Mahmooduzzafar (2010). Somatic embryogenesis in Allium sativum L. (cv. Yamuna Safed 3): Improving embryo maturation and germination with PGRs and carbohydrates. Anales de Biologia. 32:1-9.
Gill R, Saxena PK (1993). Somatic embryogenesis in Nicotiana tabacum L: Induction by thidiazuron of direct embryo differentiation from cultured leaf discs. Plant Cell Rep.12:154-159.
Riov J, Yang S (1989). Ethylene and auxin interaction in adventitious root formation in mung bean (Vigna radiata) cuttings. J. Plant Grow. Regul. 8(2):131-141.
Sandra RLF, Maria BPC, João MF, Luiz GEV (2000). The effects of silver nitrate and different carbohydrate sources on somatic embryogenesis in Coffea canephora. Plant Cell Tiss. Organ Cult. 60:5-13.
Staristky G (1970). Embryoid formation in callus cultures of coffee. Acta Botanica Neerlandica. 19:509-514.
Taiz L, Zeiger E (2003). Auxins. In: Plant Physiology. Macmillan Publishing Co., New York. p. 623.
Yasuda T, Fujii Y, Yamaguch T (1985). Embryogenic callus induction from Coffea arabica leaf explants by benzyladenine. Plant Cell Physiol. 26:595-597.
Trâm Anh
SBC Scientific
Hotline: 0945677929
Email: info@sbc-vietnam.com