Nuôi cấy mô trên cây hồ tiêu (Piper nigrum l. ) ở Pakistan. Mục tiêu chính của nghiên cứu này là để chuẩn bị các quy trình cho việc vi nhân giống các cây hồ tiêu không mầm bệnh và để đảm bảo rằng cây giống luôn chất lượng cao, đồng nhất và không bệnh tật.
 Tổng quan
Tổng quan
Hồ tiêu (Piper nigrum L.) được mệnh danh là "Vua các loài gia vị”. Nó được sử dụng rộng rãi trong các món ăn Pakistan và cũng là thuốc thảo dược được nhập khẩu hàng loạt từ các nước láng giềng. Hồ tiêu thường được trồng bằng hạt giống bởi vì các phương pháp nhân giống của các loài thực vật khác chậm và tốn thời gian. Vì vậy kỹ thuật nuôi cấy mô được coi là phương pháp nhân giống cây hồ tiêu hiệu quả và đáng tin cậy hơn để nhân giống với số lượng lớn cây trồng quan trọng về mặt kinh tế này. Nghiên cứu hiện nay đã được bắt đầu để phát triển cách thức nhân giống loài hồ tiêu. Các mẫu mô thân, lá và đỉnh chồi mọc từ cây trưởng thành được nuôi cấy trong môi trường MS được bổ sung với nồng độ khác nhau của các chất điều chỉnh tăng trưởng thực vật (2,4-D, BA, IBA). Mô sẹo tốt nhất được nuôi cấy trong môi trường MS với nồng độ BA 1,5 mg/l bởi mô đỉnh chồi. Chồi tái sinh tốt nhất trong môi trường MS với nồng độ BA 0.5 mg/l. Cây non hình thành được mọc rễ tốt nhất trong môi trường IBA 1.5 mg/l. Sau đó được trồng xuống đất và khí hậu trong môi trường sinh trưởng. Các cây phát triển tốt được trồng thử nghiệm dưới điều kiện địa phương của Hattar.
Giới thiệu
Hồ tiêu (Piper nigrum L.) thuộc họ Piperaceae. Nó là cây dây leo thân gỗ lâu năm. Hồ tiêu có nguồn gốc ở Ấn Độ, Indonesia, Malaysia, Nam Mỹ và Tây Ấn nhưng cũng được trồng rộng rãi ở các vùng nhiệt đới. Hồ tiêu là một loại gia vị phổ biến dùng để tăng hương vị cho các món ăn trên toàn thế giới. Nó được gọi là "Vua gia vị" (Srinivasan, 2007, Mathew và cộng sự, 2001). Vị cay chủ yếu là do sự có mặt của một hợp chất Piperine. Piperine là một alkaloid cay (Tripathi và cộng sự., 1996) giúp nâng cao khả năng sinh học của các cấu trúc khác nhau và sự đa dạng trị liệu của thuốc thảo dược từ cây hồ tiêu (Khajuria và cộng sự, 2002). Nó cũng chứa một lượng nhỏ safrol, pinene, sabinen, limonen, caryophyllene và hợp chất linaonol.
Nuôi cấy mô tế bào thực vật là phương pháp nuôi cấy in vitro của thực vật từ các bộ phận của cây (mô, các cơ quan, phôi, các tế bào đơn, tế bào nguyên sinh, vv) trong môi trường dinh dưỡng dưới điều kiện vô trùng (Altman, 2000). Phương pháp nuôi cấy mô in vitro hiện đang được sử dụng như một công cụ để nghiên cứu các vấn đề cơ bản trong khoa học thực vật. Ngày nay phương pháp nuôi cấy mô có thể nhân giống tất cả các giống cây trồng có giá trị về kinh tế với số lượng lớn.
Hồ tiêu cũng là một loại thuốc truyền thống quan trọng và được sử dụng để điều trị hen xuyễn, tiêu chảy mãn tính, viêm đại tràng, béo phì, xoang, sự sung huyết, sốt (Ravindran, 2000), sốt từng cơn, cảm lạnh, đau bụng, đau dạ dày và tiêu chảy (Ao et al. , 1998). Nó đã được chứng minh có hoạt tính kháng khuẩn (Dorman & Deans, 2000). Cả hai loại chiết xuất từ nước và ethanol của hồ tiêu được kiểm tra hoạt tính kháng khuẩn chống lại Bacillus cereus và Bacillus subtilus (Singh và cộng sự, 2005, Ghori & Ahmad, 2009). Nước sắc từ hồ tiêu có tác dụng tối đa đối với Staphylococcus aureus và được coi là tác nhân kháng khuẩn hoạt động mạnh nhất chống lại tất cả các chủng vi khuẩn ngoại trừ Salmonella typhi, Streptococcus intermedius, Streptococcus mitis, Streptococcus salivarius, Streptococcus sanguis và Streptococcus uberis. (Nazia Masood và cộng sự, 2006).
Nuôi cấy mô thực vật là một phương pháp nhanh và hiệu quả nhân giống cây tiêu để nhân với số lượng lớn, nhanh chóng và sạch bệnh, ổn định về di truyền và cho thế hệ con cháu đồng nhất quanh năm.
Hồ tiêu có thể được nhân giống bằng hạt, cành, phân lớp và ghép cành. Việc nhân giống hạt giống thường dẫn đến sự biến đổi di truyền do sự hình thành các tái tổ hợp, trong khi các phương pháp nhân giống tiêu khác chậm và tốn nhiều thời gian (Atal & Banga, 1962). Vì vậy, cần phải đưa ra các phương pháp hiệu quả để nhân giống hồ tiêu nhanh hơn. Trong bối cảnh này, nuôi cấy tế bào thực vật là phương pháp hiệu quả và đáng tin cậy nhất cho việc nhân giống cây hồ tiêu một cách nhanh chóng và số lượng lớn không mầm bệnh, ổn định về mặt di truyền, đồng nhất ở các thế hệ tiếp theo quanh năm (Hu & Wang, 1983). Các kỹ thuật nuôi cấy mô đã có vai trò quan trọng trong việc nhân giống dòng vô tính, bảo tồn phôi và cải thiện cây trồng trong hồ tiêu (Bhat và cộng sự, 1995. Sajc et al, 2000). Đó là lý do tại sao nhân giống in vitro là một lựa chọn cao cấp và thay thế cho việc nhân giống truyền thống (Abbasi và cộng sự, 2007; George & Sherrington, 1984).
Mục tiêu chính của nghiên cứu này là để chuẩn bị các quy trình cho việc vi nhân giống các cây hồ tiêu không mầm bệnh để đưa vào sử dụng tại Pakistan và để đảm bảo rằng cây giống luôn chất lượng cao, đồng nhất và không bệnh tật.
Vật liệu và Phương pháp
Các cây giống được thu thập từ Ấn Độ và các mô được sử dụng cho việc nghiên cứu là các mô phân sinh của lá, đốt thân và đỉnh chồi của cây hồ tiêu khoẻ mạnh trồng trong nhà kính tại Trung tâm nghiên cứu Qarshi Herb, Hattar, quận Haripur. Các đoạn mẫu nuôi cấy vô trùng (6-7mm) được cắt thành từng đoạn dài 4 - 5mm. Các mô thu được sẽ được rửa bằng nước máy và sau đó được xử lý bằng chất tẩy gia đình trong 5 phút. Tiếp theo đó là lần rửa thứ hai với nước máy để loại bỏ tất cả các tẩy. Sau đó các mô được xử lý bằng HgCl2 0,1% trong một phút. Để loại bỏ tất cả các dấu vết của HgCl2, các nhà khoa học được rửa ba lần với nước cất tiệt trùng. Mỗi mô nuôi cấy được đưa vào môi trường MS với các nồng độ hormone khác nhau. Cẩn thận không để nhúng các mô hoàn toàn vào môi trường cũng như đặt 1 đầu chạm vào môi trường agar để đảm bảo cung cấp dinh dưỡng thích hợp cho các mô nuôi cấy.
Các ống nuôi cấy đã được niêm phong ngay sau khi cấy. Các bước tương tự được lặp lại cho sự nhân giống chồi. Kẹp, dao mổ, kim và dụng cụ khác đã được khử trùng bằng cách nhúng ethanol và đốt trước khi sử dụng. Tất cả các mẫu thử nghiệm được đặt dưới ánh sáng 16 giờ và 8 giờ trong tối ở phòng có điều hòa không khí, được chiếu sáng bằng đèn huỳnh quang trắng 40W. Cường độ ánh sáng được điều chỉnh từ 1000-2000 lux. Nhiệt độ của phòng nuôi cấy được duy trì ở 25 ± 2ºC. Đối với sự hình thành chồi từ các mô phân sinh đỉnh chồi, các nồng độ BA khác nhau (0.5, 1, 1.5, 2, 2.5 và 3 mg/l) đã được thử nghiệm. Quá trình nuôi cấy được thực hiện trong khoảng 21 ngày. Các đoạn nút từ các chồi được nhân giống phát triển đã được nuôi cấy một lần nữa để kích thích nhiều chồi hơn. Các chồi được tạo ra nhiều lần được cắt và từng chồi được đặt trong môi trường MS có nồng độ IBA và IAA khác nhau để kích thích ra rễ. Dữ liệu được ghi lại sau 5 tuần đối với tần suất hình thành chồi và rễ. Thí nghiệm được thực hiện với 30 lần nhân bản. Các phép khai thác cho thấy phản ứng tích cực đã được bao gồm trong phân tích thống kê để xác định độ lệch tiêu chuẩn và hiệu quả của phương sai.
Kết quả và thảo luận
Trong nghiên cứu hiện tại, các chất điều chỉnh tăng trưởng khác nhau (Auxions và Cytokinins) đã được thử nghiệm cho sự sinh trưởng của cây hồ tiêu từ lá, thân và đỉnh chồi và sự hình thành bộ phận từ mô sẹo để tạo ra cây không bệnh của Piper nigrum L. Nhiều kỹ thuật nuôi cấy in vitro thành công cho vi nhân giống Hồ tiêu đã được báo cáo bằng cách sử dụng mô ở đỉnh chồi (Nazeem et al., 1992, Philip và cộng sự, 1992, Babu và cộng sự, 1993, Joseph et al., 1996, Philip và cộng sự, 1992), mô lá (Sujatha và cộng sự., 2003), mô nút (Bhat và cộng sự., 1992), mô rễ Bhat và cộng sự., 1995) và từ các hạt giống (Nair & Gupta, 2006). Các cây non được tái sinh từ mô sẹo của những cây trồng bằng hạt và chồi cây cũng đã được báo cáo, nhưng hầu hết các nỗ lực để tái tạo cây trồng từ cây trưởng thành không thành công (Mathews & Rao, 1984). Kết quả của nghiên cứu này đã chứng minh rõ ràng sự tái sinh của cây con từ cây hồ tiêu trưởng thành thông qua nuôi cấy mô. Tác dụng của các hooc môn khác nhau đối với sự sinh trưởng và sự hình thành bộ phận được mô tả như sau:
Ảnh hưởng của các nồng độ 2,4-D khác nhau đối với sự sinh trưởng của tế bào: Đối với sự hình thành mô sẹo in vitro từ lá, thân và đỉnh chồi được lấy từ cây hồ tiêu trưởng thành. Murashige & Skoog Medium (1962) được bổ sung với nồng độ 2,4-D khác nhau, dao động từ 0,5 mg/l đến 3,0 mg/l. Sự hình thành mô sẹo từ mô lá là thấp (+) với nồng độ 0,5, 1,0 và 1,5 mg/l 2,4-D. Trong khi ở nồng độ cao hơn 2,0, 2,5 và 3,0 mg/l cho thấy sự sinh trưởng tế bào được đáp ứng thuận lợi (++). Những mẫu mô ở thân cho sự hình thành mô sẹo kém (+) trên nồng độ 1,0 và 3,0 mg/l, trong khi đó phần còn lại phát triển thuận lợi (++) ở nồng độ 2,4-D 0,5, 1,5, 2,0 và 2,5 mg/l . Mẫu mô đỉnh chồi cho số lượng nhỏ mô sẹo với nồng độ 2, 4-D là 1,0, 2,0 và 3,0 mg/l. Trong khi 0,5, 1,5 và 2,5 mg/l cho thấy đáp ứng sự sinh trưởng tế bào thuận lợi (++). Tuy nhiên, 2,4-D đã không sản xuất số lượng mô sẹo phù hợp ở hầu hết tất cả các nồng độ và các mẫu mô thử nghiệm. Các mô sẹo được hình thành là cứng, không chảy, trắng nâu và không tạo phôi (Bảng & hình 1, 2 và 3).
Ảnh hưởng của các nồng độ BA khác nhau đối với sự sinh trưởng của tế bào: Sự hình thành mô sẹo từ mô lá là thuận lợi ở nồng độ từ 0,5 đến 2,0 mg/l (++), trong khi ở nồng độ 2,5 và 3,0 mg/l sự hình thành mô sẹo rất ít. Kết quả phù hợp với Philip (1992) thu được mô sẹo bằng cách nuôi cấy mô lá trên môi trường MS bổ sung BA 1 μM cùng với IAA.
Đối với mẫu mô từ thân cho phản ứng (++) ở liều 0,5 mg/l, nhưng ở nồng độ 1,0 và 1,5 mg/l BA việc hình thành mô sẹo là rất tốt (+++). Ở nồng độ cao hơn 2,0 và 2,5 mg/l thì sản sinh mô sẹo kém (+) và ở 3,0 mg/l không có mô sẹo được hình thành (-). Kết quả của chúng tôi tương tự như Bhat (1995), người đã báo cáo rằng ở nồng độ BA cao hơn (5-10 μM), phản ứng sinh trưởng tế bào ở các mô nút của P. nigrum là ít hơn.
Bảng 1. Phản ứng sinh trưởng tế bào từ các mô lá của Piper nigrum L., ở các sự kết hợp hoocmon/ nồng độ khác nhau của các chất điều chỉnh tăng trưởng (PGR).
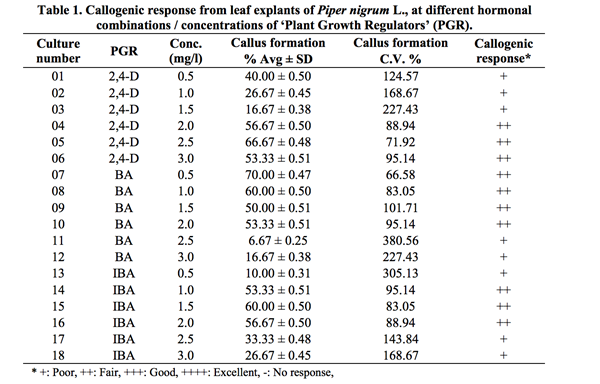
Bảng 2. Phản ứng sinh trưởng tế bào từ các mô thân của Piper nigrum L., ở các sự kết hợp hoocmon/ nồng độ khác nhau của các chất điều chỉnh tăng trưởng (PGR).
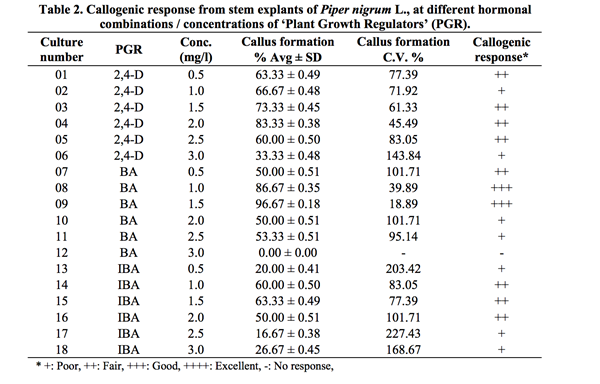
Bảng 3. Phản ứng sinh trưởng tế bào từ các mô đỉnh chồi của Piper nigrum L., ở các sự kết hợp hoocmon/ nồng độ khác nhau của các chất điều chỉnh tăng trưởng (PGR).
Bảng 4. Sự hình thành chồi từ các mô sẹo của Piper nigrum L., ở các sự kết hợp hoocmon/ nồng độ khác nhau của các chất điều chỉnh tăng trưởng (PGR).
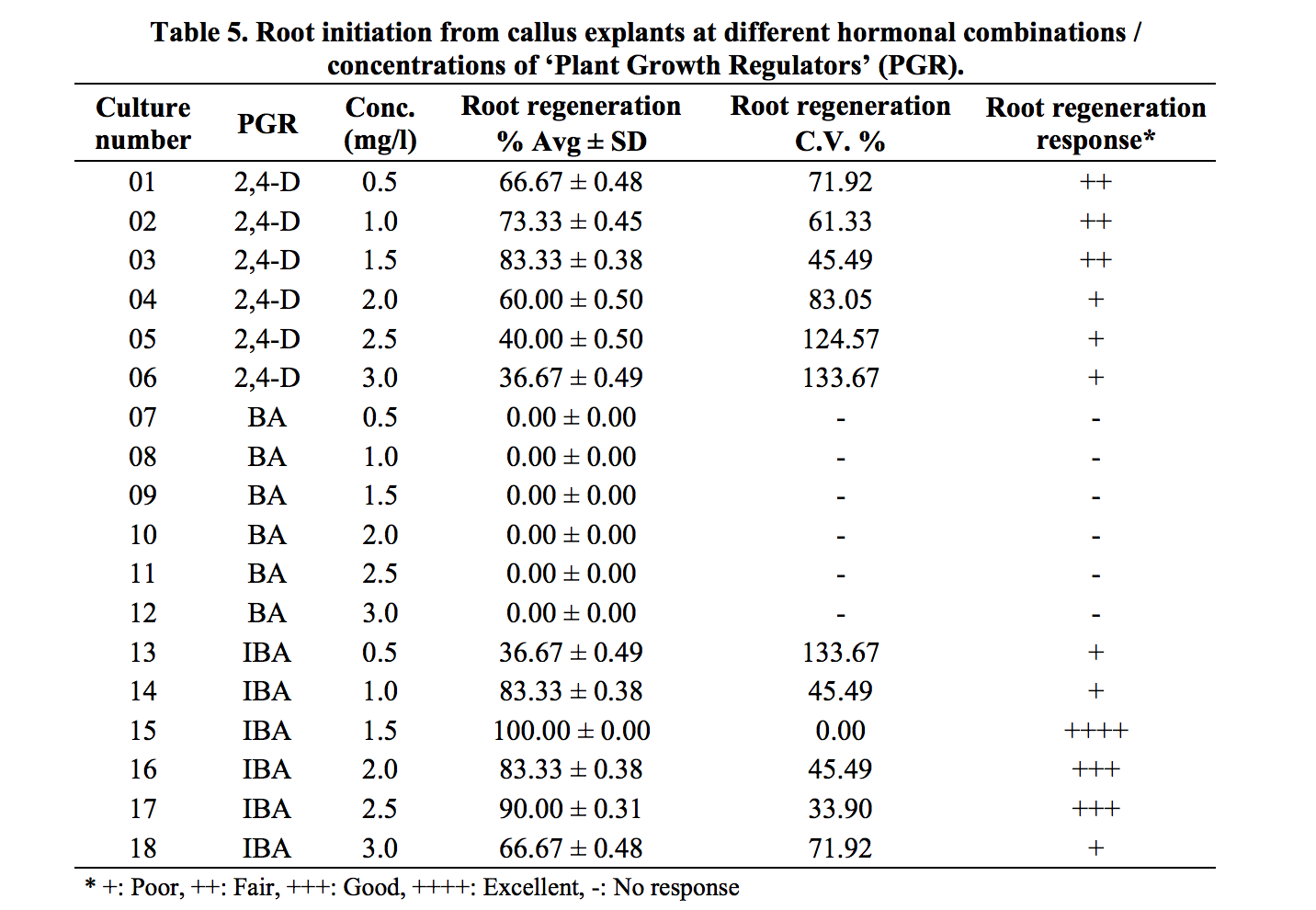
Bảng 5. Sự hình thành rễ từ các mô sẹo của Piper nigrum L., ở các sự kết hợp hoocmon/ nồng độ khác nhau của các chất điều chỉnh tăng trưởng (PGR).
Biểu đồ 1. Phản ứng sinh trưởng tế bào từ các mô lá của Piper nigrum L., ở các sự kết hợp hoocmon/ nồng độ khác nhau của các chất điều chỉnh tăng trưởng (PGR).
Biểu đồ 2. Phản ứng sinh trưởng tế bào từ các mô thân của Piper nigrum L., ở các sự kết hợp hoocmon/ nồng độ khác nhau của các chất điều chỉnh tăng trưởng (PGR).
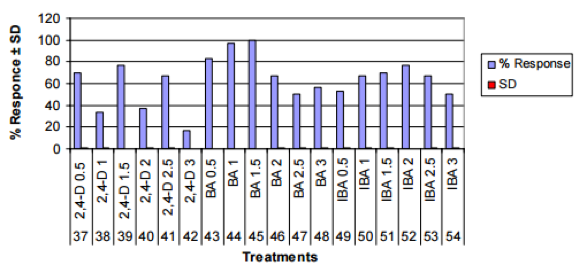 Biểu đồ 3. Phản ứng sinh trưởng tế bào từ các mô đỉnh chồi của Piper nigrum L., ở các sự kết hợp hoocmon/ nồng độ khác nhau của các chất điều chỉnh tăng trưởng (PGR).
Biểu đồ 3. Phản ứng sinh trưởng tế bào từ các mô đỉnh chồi của Piper nigrum L., ở các sự kết hợp hoocmon/ nồng độ khác nhau của các chất điều chỉnh tăng trưởng (PGR).
Biểu đồ 4. Sự hình thành chồi tái sinh từ mô sẹo của Piper nigrum L., ở các sự kết hợp hoocmon/ nồng độ khác nhau của các chất điều chỉnh tăng trưởng (PGR).
Sung. 5. Sự khởi đầu từ sự phát triển của callus ở các kết hợp hoocmon / nồng độ khác nhau của 'Regulators Growth Plant Growth' (PGR).
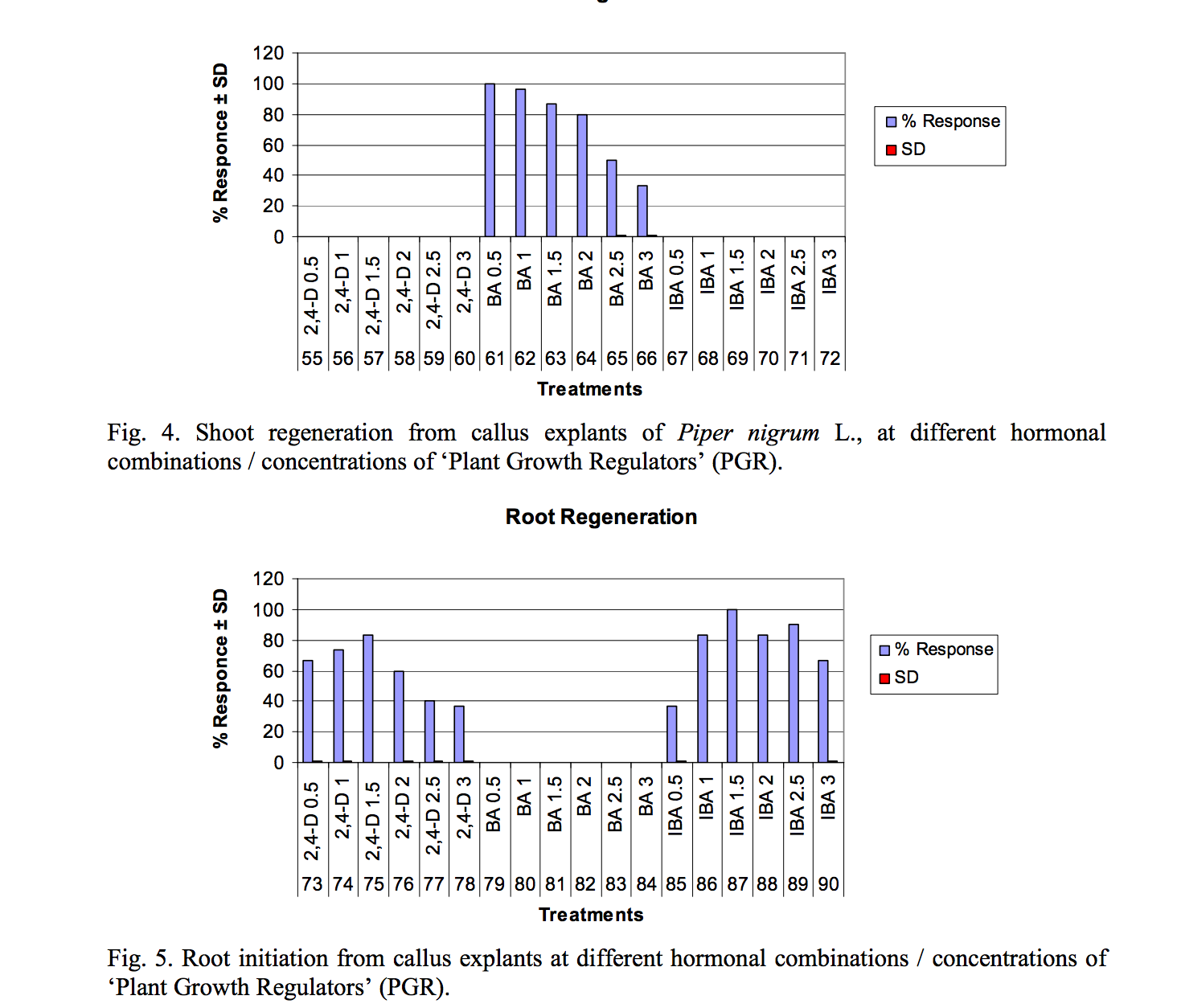
Ảnh hưởng của các nồng độ khác nhau của 2,4-D, BA và IBA đối với các bộ phận: Với nồng độ khác nhau của auxins, 2,4-D và IBA (từ 0,5-3,0 mg / l) trên môi trường MS, không có phản ứng chồi tái sinh (-) được thấy từ mô sẹo. Các kết quả phù hợp với Anand & Rao (2000), người đã quan sát thấy rằng các mô đỉnh chồi và các mô đốt thân không kích thích sự tái tạo chồi trong môi trường nuôi cấy không có cytokinin. Ảnh hưởng của các nồng độ BA khác nhau lên sự hình thành chồi từ mô sẹo được trình bày trong Bảng 4. Kết quả cho thấy khi dùng 0.5 mg/l BA trong môi trường MS, sau 14 ngày, 100% hình thành chồi (++++) từ mô sẹo. Sự hình thành chồi nhiều (+++) được ghi nhận ở 1.0 & 1.5 mg/l và ở mức vừa phải (++) với 2.0 mg/l BA. Các kết quả trái ngược với Rubluo và Barroso (1992) đã kết luận BA và IAA không hiệu quả trong việc hình thành chồi. Ở nồng độ cao hơn, tỷ lệ hình thành các bộ phận giảm dần. Sự bắt đầu chồi non là rất ít ở 2,5 và 3,0 mg/l BA cho thấy nồng độ BA cao sẽ làm giảm tỷ lệ hình thành bộ phận. Anand & Rao (2000) cũng báo cáo rằng việc tăng nồng độ BA từ 0 đến 6,6 μM tăng cường sự tái sinh nhưng tăng thêm nồng độ BA và kinetin số lượng chồi hình thành bị hạn chế.
Các nồng độ khác nhau của BA (cytokinin) dao động từ 0,5-3,0 mg/l trong môi trường MS không hình thành rễ (-) từ những chồi tái sinh bởi vì quá trình hình thành, phát triển và kéo dài của rễ In vitro thường đòi hỏi môi trường có chứa Auxin (Azad và cộng sự, 2003).
Khi dùng nồng độ 2,4-D (0.5, 1.0 và 1.5 mg/l), số lượng rễ đã được hình thành nhiều (++) và khi nồng độ tăng từ 2.0, 2.5 đến 3.0 mg/l, sự hình thành rễ là ít đi (+). Nồng độ thấp hơn của IBA sự hình thành rễ là rất ít (+) ở hầu hết các mẫu nuôi cấy. Ở nồng độ 2.0 và 2.5 mg/l sự hình thành rễ là (+++), trong khi nồng độ cao hơn 3,0 mg/l việc tạo rễ kém (+). Kunisaki và cộng sự, (2003) đã báo cáo rằng các chồi vi mô thu được từ chồi tái sinh in vitro đã ra rễ trong môi trường cơ bản ½ MS đối với loài Piper methysticum.
Ở nồng độ IBA 1,5 mg/l trong môi trường MS ở tất cả các nền văn hoá ra rễ rất tốt (++++) trong vòng 8 ngày (Bảng và hình 5). Trái ngược với kết quả của chúng tôi, Bhat (1995); Azad (2003) đã sử dụng IAA 1μM để kích thích ra rễ từ các chồi tái sinh.
Các cây non đã ra rễ được lấy ra từ môi trường nuôi cấy và chuyển sang chậu chứa phân, cát, và đất trồng với tỷ lệ 1:1:1. Sau đó, các cây được bao phủ bằng túi polythene trong suốt trong hai tuần để làm quen với khí hậu (Philip và cộng sự, 1992). Anand & Rao (2000) đã báo cáo việc sử dụng buồng tăng trưởng trong điều kiện độ ẩm cao để giúp cây con thích nghi với khí hậu. Những bao phủ polythene được loại bỏ dần trong khoảng thời gian 2 tuần (Bhat và cộng sự, 1995). Những cây hồ tiêu nuôi cấy mô đã được cho làm quen với khí hậu theo điều kiện khí hậu của Hattar Industrial Estate, KPK, Pakistan, đặc biệt đối với độ ẩm và nhiệt độ trong khí quyển.
Các cây đã ra rễ được chuyển sang nhà kính trong bốn tuần và sau đó trồng thử nghiệm trên các cánh đồng tại Hattar. Hồ tiêu là cây thân dây leo nên cần hỗ trợ cho cây leo bám. Bốn loại cây khác nhau được lựa chọn để làm trụ leo cho cây tiêu là Eucalyptus camaldulensis, Grevillea robusta, Pinus roxburghii và Phyllanthus emblica. Cây tiêu phát triển tốt nhất trên cây Silver Oak (Grevillea robusta) quanh năm. Cây hồ tiêu là cây chịu lạnh yếu. Các cây tiêu được trồng trong nhà kính vào mùa đông có sức khoẻ tốt hơn so với những cây non được trồng ngoài không khí.
Phần kết luận
Nghiên cứu này có thể được sử dụng như là một quy trình cho việc nuôi cấy mô của thông qua mô sẹo và mô phân sinh. Các cây nuôi cấy mô phải được làm quen với môi trường trước khi đưa trồng ở ruộng và phải được trồng ở những đồng ruộng ít sương giá hoặc trong nhà kính.
Tài liệu tham khảo
Anand, A. and C.S. Rao. 2000. A rapid In vitro propagation protocol for Piper barberi gamble. A critically endangered plant. In vitro Cell. Dev. Biol. Plant, 36: 61-64.
Ao, P., S. Hu and A. Zhao. 1998. Essential oil analysis and trace element study of the roots of Piper nigrum L. Zhongguo Zhong Yao Za Zhi., 23(1): 42-43.
Atal, C.K. and S.S. Banga. 1962. Phytochemical studies on stem of P. longum. Indian Jour. Pharm., 24: p.105.
Azad, M.A.K., M.N. Amin and F. Begum. 2003. Rapid clonal propagation of a medicinal plantAdhatoda vasica Nees. using tissue culture techniques. Online J. Biol. Sci., 3: 172-182.
Babu, N.K., R. Lukose and P.N. Ravindran. 1993. Tissue culture of tropical spices. Proceeding of International Symposium on Genetics Engineering and Tissue Culture for Crop Pest and Disease Management (Ed. Vidhuasekharan). Daya Publishing House, New Delhi pp. 257-267.
Bhat, S.R., K.P.S. Chandel and S.K. Malik. 1995. Plant regeneration from various expalnts of cultivated Piper species. Plant Cell Rep., 14: 398- 402.
Dorman, H.J. and S. Deans. 2000. Antimicrobial agents from plants; Antibacterial activity of plant volatile oils. J. Appl. Microbiol., 88: 308- 316.
George, E.F. and P.D. Sherrington. 1984. Plant propagation by tissue culture. London: Exegetics Ltd. Ghori, I. and S.S. Ahmad. 2009. Antibacterial activity of Honey, Sandal oil and Black pepper. Pak. J. Bot., 41(1): 461-466.
Hu, C.Y. and P.J. Wang. 1983. Handbook of plant cell culture, New York; Macmillan. 1:177- 227.
Joseph, L., P.A. Nazeem, M.S. Thampi, S. Philip and M. Balachandran. 1996. In vitro techniques for mass multiplication of black pepper (Piper nigrum L.) and ex vitro performance of the plantlets. J. Plant Crop, 24 (suppl.): 511-516.
Khajuria, A., N. Thusu and U. Zutshi. 2002. Piperine modulates permeability characteristics of intestine by inducing alterations in membrane dynamics: influence on brush border membrane fluidity, ultra-structure and enzyme kinetics. Phytomedicine, 9(3): 224-231.
Kunisaki, J., A. Araki and Y. Sagawa. 2003. Micropropagation of ‘Awa (Kava, Piper methysticum). Bio., 4: 1-11.
Masood, N., A. Chaudhry and P. Tariq. 2006. Bactericidal Activity of Black Pepper, Bay Leaf, Aniseed and Coriander Against Oral Isolates. Pak. J. Pharm. Sci., 19(3): 214-218.
Mathew, P.J., P.M. Mathew and V. Kumar. 2001. Graph clustering of Piper nigram L. (Black pepper). 118: 257-264.
Mathews, V.H. and P.S. Rao. 1984. In vitro responses in black pepper (Piper nigrum). Curr. Sci., 53: 183-186.
Murashige, T. and F. Skooge. 1962. A revised medium for rapid growth and bioassay with tobacco tissue cultures. Physiol Plant, 15: 473-497.
Nair, R.R. and Gupta. 2006. High frequency plant regeneration through cyclic secondary somatic embryogenesis in black pepper (Piper nigrum L.) Plant Cell Rep., 24: 699-707.
Nazeem, P.A., L. Joseph, C.K. Geetha and G.S. Nair. 1992. In vitro cloning of black pepper (Piper nigrum L.). J. Plant. Crop, 20: 257-259.
Philip, V.J., J. Dominic, G.S. Triggs and N.M. Dickinson. 1992. Micropropagation of black pepper (Piper nigrum L.) through shoot tip cultures. Plant Cell Rep., 12: 41-44.
Ravindran, P.N. 2000. Black pepper: Piper nigrum. Series: Medical and Aromatic Plants – Industrial Profiles. Center for Medicinal Plants Research. Kerala, India. ISBN: 9057024535. Publisher Availability: In Stock CRC Press pp. 1-526.
Rubluo, A. and A.L. Barroso. 1992. In Vitro morphogenetic responses and cytokinin-auxin interaction for callus production in pepper, Anales Inst. Biol. Univ. Nac. Auton. Mex. Ser. Bot., 63: 195-201.
Sajc, L., D. Grubisic and C. Vunjak-Novakovic. 2000. Bioreacters for plant engineering: An outlook for further research. Biochem. Eng. J., 4: 89-99.
Singh, G., P. Marimuthu, H.S. Murali and A.S. Bawa. 2005. Antioxidative and antibacterial potentials of essential oils and extracts isolated from various spice materials. Journal of Food Safety, 25(2): p. 130.
Srinivasan, K, 2007. Black pepper and its pungent principle-piperine: A review of diverse physiological effects Critical Rev. Food Nut., 47: 735-748.
Sujatha, R., C. Babu and P.A. Nazeem. 2003. Histology of organogenesis from callus cultures of black pepper (Piper nigrum L). J. Tropical Agric., 41: 16-19.
Tripathi, A.K., D.C. Jain and S. Kumar 1996. Secondary metabolites and their biological and medical activities of Piper species plants. J. Med. Aromatic Plant Sci., 18: 302-321.
Hiếu Minh
SBC Scientific
Hotline: 0945677929
Email: info@sbc-vietnam.com