Ying Chen a,b,c, Uromi Manage Goodale a,b,d, Xu-Li Fan a,b, Jiang-Yun Gao a,b,∗
a Phòng thí nghiệm Trọng điểm về Nguồn tài nguyên Thực vật Nhiệt đới và sử dụng bền vững, Vườn Bách thảo Nhiệt đới Xishuangbanna, Học viện Khoa học Trung Quốc, Mạnh Giai, Vân Nam 666303, Trung Quốc
b Trung tâm Bảo tồn Tổng hợp, Vườn Bách thảo Xishuangbanna, Học viện Khoa học Trung Quốc, Mạnh Giai, Vân Nam 666303, Trung Quốc
c Đại học Cao học của Viện Hàn lâm Khoa học Trung Quốc, Bắc Kinh 100049, Trung Quốc
d Tổ chức Sinh thái học và Nhóm Sinh thái thực vật, Phòng thí nghiệm trọng điểm về Bảo tồn và Sử dụng Tài nguyên Sinh học cận nhiệt đới của Trường Đại học Lâm nghiệp, Đại học Quảng Tây, Daxuedonglu 100, Nam Ninh 530005, Quảng Tây, Trung Quốc
Nhận bài: 29/11/2014
Nhận phản biện: 5/1/2015
Nhận đăng: 5/1/2015 đăng online 20/1/2015
Paphiopedilum spicerianum nằm trong danh sách một trong những loài thực vật hoang dã với quần thể rất nhỏ (PSESP). Quy trình cho nảy mầm không cộng sinh (nảy mầm in vitro) và phát triển cây con in vitro nhằm mục đích sản xuất cây con để trả về tự nhiên. Tỉ lệ nảy mầm cao nhất đạt được ở RECW với chu kì nuôi 24 giờ tối sau khi xử lý với 1% NaOCl khoảng 40 phút và nảy mầm sau 30 ngày. Tuy nhiên, protocorm của chúng có màu trắng và không phát triển được nữa. Trong cùng điều kiện nuôi cho nảy mầm, MSCW có tỉ lệ nảy mầm thấp hơn nhưng protocorm lại xanh và khỏe hơn. Trong 4 môi trường thử nghiệm hình thành cây, thì môi trường Hyponex No 1 với 1.0 mg/L α-naphthalene acetic acid, 0.5 g/L than hoạt tính và 10% dịch chiết chuối banana có hiệu quả nhất. Cây con phát triển vượt trội trong 6 môi trường thủ nghiệm trong 4 tháng, với tốc độ phát triển lá cao nhất ở cả 6 môi trường sử dụng cho nuôi cây, có bổ sung 1.0 mg/L 6-benzyladenine để thúc đẩy lá phát triển. Thử nghiệm Fluorescein diacetate (FDA) trên hạt cho thấy nồng độ cao của muối này trong môi trường và thời gian tiếp xúc lâu hơi với NaOCl làm giảm sự nảy mầm bởi vì chúng gây tổn thương lên vỏ hạt và tế bào phôi.
Từ khóa: Bảo tồn hoa lan, Paphiopedilum spicerianum , PSESP đối với cây con ở Trung Quốc, Phát triển hạt, Sự nảy mầm của hạt, Khử trùng hạt
1. Giới thiệu
Việc bảo tồn các loài thực vật quý hiếm và bị đe dọa bằng phương pháp nhân giống in vitro cũng tương tự như các loài khác, nhưng cần được khắc phục những thách thức do hạn chế số lượng vật liệu để nuôi cấy (Fay, 1992; Sarasan và cộng sự, 2006). Trong phát triển các phương pháp nuôi cấy in vitro đối với các loài thực vật có tầm quan trọng bảo tồn, thì việc sử dụng hạt giống phù hợp hơn so với các phương pháp nuôi cấy mô tế bào khác, bởi vì chúng cho phép duy trì một cơ sở di truyền rộng lớn hơn. Trong nghiên cứu này tôi báo cáo về những thử nghiệm nhanh và đáng tin cậy, có thể được sử dụng để đánh giá sự phù hợp của môi trường nuôi cấy mô, trong quy trình cho nảy mầm và phát triển cây con từ hạt, lên loài lan đang bị đe dọa nguy cấp Paphiopedilum spicerianum (H.G. Reichenbach).
Các thử nghiệm như thế này cần ít hạt giống vì thế cho phép các nhà bảo tồn tiết kiệm được nguồn hạt giống hạn chế của các loài cây, chỉ có thể tái khai thác trong tự nhiên (Stewart, 2008; Swarts và Dixon, 2009; Ren và cộng sự, 2012).
Paphiopedilum spicerianum được tìm thấy từ phía bắc Ấn Độ đến phía nam Vân Nam, Trung Quốc và Myanmar, và được khai thác rất nhiều để trồng trong vườn cảnh trong những năm gần đây (Liu và cộng sự, 2009). Ở Trung Quốc, có có 1 quần thể đơn lẻ khoảng 10 cá thể trưởng thành được tìm thấy vào năm 2006 ở Phổ Nhĩ, Vân Nam (Ye và Luo, 2006). Đây là những loài thực vật mọc dưới đất ở sườn dốc ven bờ sông (Hình 1a ) và môi trường sống bị đe dọa nghiêm trọng bởi việc độc canh đồn điền cà phê. Là một thành viên trong họ Orchidaceae, P. spicerianum được bảo vệ trong Phụ lục I của Công ước về Thương mại Quốc tế các loài động thực vật hoang dã nguy cấp (CITES, 2013) và nằm trong 38 loài lan ở Trung Quốc nằm trong “Chương trình bảo tồn thực vật hoang dã có quần thể rất nhỏ” ((PSESP; (State Forestry Administration of China, 2012)). Trả về tự nhiên là ưu tiên hàng đầu trong chiến lược bảo tồn đối với các loài thực vật PSESP, là những loài mà có số lượng quần thể rất ít do sự can thiệp nghiêm trọng của con người trong thời gian gần đâu và do sự đào thải tự nhiên các loài quý hiếm (Cục Quản lý lâm nghiệp Trung Quốc, 2012; Ren và cộng sự, 2012; Ma và cộng sự, 2013).

Hình 1. P. spicerianum trong tự nhiên có hoa, quả, hạt và cây được phát triển từ hạt nảy mầm in vitro sẵn sàng để đưa về tự nhiên. (a) P. spicerianum trên mặt đất phủ trên vách đá trong tự nhiên. (b) Hoa của P. spicerianum từ cây trồng ở vườn ươm XBTG. (c) Quả chín của P. spicerianum vào 365 DAP. (d) Hình chụp hạt P. spicerianum dưới kính hiển vi điện tử. (e) và (f) Cây con sau giai đoạn protocorm được cấy chuyền vào môi trường có Hyponex No 1 với 1.0 mg/L α-naphthalene acetic acid, 0.5 g/L than hoạt tính và 10% dịch chiết chuối, lần lượt ở khoảng 1 tháng và 3 tháng. (g) Cây con được trồng ra đất chuẩn bị đưa về tự nhiên.
Do đặc tính sinh học chuyên biệt, nên rất khó để cho các hạt giống hoa lan nảy mầm và có được đủ cây con để trồng cây trong tự nhiên. Mặc dù năm 1922 Knudson đã khám phá ra cách làm cho hạt lan nảy mầm mà không cần có sự cộng sinh, và phương pháp này đã cho nảy mầm thành công ở nhiều loài thực vật giúp cho công tác bảo tồn nhiều loài lan bị đe dọa nguy cấp (Sgarbi và cộng sự, 2009; Mohanty và cộng sự, 2012). Phương pháp cho nảy mầm không cộng sinh in vitro phải được phát triển tùy vào mỗi loài bởi vì điều kiện nuôi cấy mô ở mỗi bước có sự đặc thù cho từng loài (Arditti, 1967; Zeng và cộng sự, 2013). P. spicerianum thuộc phân họ Cypripedioideae, được biết đến là rất khó nảy mầm (Arditti, 1967; Kauth và cộng sự, 2008; Zeng và cộng sự, 2013).
Nảy mầm in vitro có thành công hay không phụ thuộc vào điều kiện của hạt, chẳng hạn như độ chín của vỏ quả và nguồn gốc, cũng như là điều kiện vật lí cho nảy mầm và thành phần trong môi trường phát triển (Arditti, 1967; Kauth và cộng sự, 2008; Zeng và cộng sự, 2013). Ở chi Paphiopedilum, ảnh hưởng của độ chín của vỏ quả (được xác định theo số ngày sau khi thụ phấn –DAP) lên sự nảy mầm thành công giữa các loài (Lee, 2007; Long và cộng sự, 2010). Việc thụ phấn chéo ở Paphiopedilum cho thấy hạt giống có khả năng nảy mầm cao hơn so với hạt có được thông qua việc tự thụ phấn (Stimart và Ascher, 1981). Hơn nữa, các điều kiện môi trường tăng trưởng như thành phần, nguồn carbon, các chất điều sinh trưởng thực vật, các chất bổ sung tự nhiên, (Chen và cộng sự, 2004a, b, Long và cộng sự, 2010), thời gian khử trùng hạt (Lee, 2007) và ánh sáng (Stimart và Ascher, 1981) cũng có thể ảnh hưởng đáng kể đến sự nảy mầm thành công của các loài Paphiopedilum. Mất nhiều thời gian và nguồn lực để phát triển được quy trình cho nảy mầm in vitro đối với các loài đang bị đe dọa, và khả năng thử nghiệm các điều kiện tốt nhất thì rất giới hạn đối với các hạt giống của chúng.
Ở vườn bách thảo nhiệt đới Tây Song Bản Nạp (Xishuangbanna Tropical Botanical Garden –XTBG), Vân Nam, Trung Quốc, một phần của dự án bảo tổng hợp tập trung vào việc ngăn chặn sự tiệt chủng của các loài lan quý hiếm và có nguy cơ bị tuyệt chủng, chúng tôi phát triển quy trình cho nảy mầm in vitro cho loài P. spicerianum. Chúng tôi đã thử nghiệm xem môi trường nào thích hợp cho mỗi giai đoạn nảy mầm bằng cách thử nhiều thành phần môi trường, thời gian khử trùng với NaOCl 1%, và ánh sáng. Dựa vào những nghiên cứu trước đây đối với loài Paphiope-dilum, và qua những thử nghiệm sơ bộ, chúng tôi cho rằng sự nảy mầm cao nhất sẽ xảy ra ở môi trường MS (Murashige and Skoog, 1962) có bổ sung nước dừa (Chen và cộng sự, 2002, 2004a, b; Zeng và cộng sự, 2012), trong điều kiện tối (Pierik và cộng sự, 1988), và được khử trùng với NaOCl 1% khoảng 60 phút (Lee, 2007). Chúng tôi đã thử nghiệm trên 4 môi trường trong lần cấy đầu tiên để hình thành cây và 6 môi trường cho sự phát triển về sau. Trong khi quy trình được phát triển chúng tôi sử dụng kỹ thuật chụp ảnh dưới kính hiển vi điện tử quét (scanning electron microscopic techniques )và phương pháp nhuộm bằng Fluorescein Diacetate (FDA) để xác định ảnh hưởng của điều kiện thử nghiệm đến lớp vỏ hạt và sự toàn vẹn phôi. Nghiên cứu này lần đầu báo cáo về các thử nghiệm toàn diện theo kinh nghiệm để phát triển quy trình nảy mầm in vitro cho P. spicerianum, kết hợp với nhuộm và kỹ thuật chụp ảnh, có thể ứng dụng rộng rãi cho các loài quý hiếm và có nguy cơ bị tiệt chủng khác.
2. Vật liệu và phương pháp
2.1 Vật liệu từ cây P. spicerianum và lựa chọn hạt giống
P. spicerianum (Hình 1a) là hình ảnh nơi ẩm ướt và có bóng mát của đất phủ trên các mỏm đá trong rừng tại cao độ 900 và 1400 m (Liu và cộng sự, 2009). Ra hoa trong tự nhiên từ tháng 9 đến tháng 10, và quả chín sau 11 tháng đến 1 năm kể từ khi được thụ phấn (Liu và cộng sự, 2009). Tháng 9/2012, 38 cây được tìm thấy ở Phổ Nhĩ, phía nam Vân Nam, 18 cây được thu để bảo tồn in situ tại vườn XTBG. Tháng 11/2012, sự thụ phấn chéo đã được thực hiện giữa 3 cá thể đã nở hoa tại vườn XTBG (Hình 1b) và tháng 10/2013, 2 quả chín sắp nứt ra có vỏ chuyển sang màu nâu (365 DAP) (Hình 1c) được thu hoạch. Sau đó đem hạt khử quả và cho nảy mầm. Hạt được kiểm tra tính khả thi bằng thử nghiệm FDA như sau: hạt được ngâm trong 1% NaOCl khoảng 15 phút và rửa lại 2 lần bằng nước khử ion, giữ trong nước khoảng 16 giờ, lặp lại 4 lần, trong ống tiêm có vải nilon đường kính lỗ 45 µm. Hạt ở mỗi lần lặp lại được đặt vào kính hiển vi và được trộn theo tỉ lệ 1:1 với 0.5% (w/v) FDA hòa trong aceton. Để phản ứng khoảng 15 phút để tích lũy fluorescein trong tế bào sống (Clarke và cộng sự, 2001). Hạt được kiểm tra dưới kính hiển vi UV-fluorescence (LSM710 ImagerZ2, Zeiss, Đức) để kiểm tra tình trạng vỏ ngoài và khả năng sống của phôi (Copeland and McDonald, 2001). Các hạt tươi không xử hóa chất, có hình ảnh ở Hình 1d, sử dụng kính hiển vi điện tử quét (a scanning electron microscope) (EVO LS10, Zeiss, Đức). Các thí nghiệm về sau trên hạt đã thu hoạch được tiến hành trong phòng nuôi cấy mô ở điều kiện vô trùng ở 25 ± 2.0°C và độ ẩm tương đối 45%.
2.2 Đánh giá sơ bộ về các thành phần môi trường phù hợp cho sự nảy mầm (giai đoạn 1)
Trong thí nghiệm của mình, chúng tôi điều chỉnh 2 môi trường; agar giảm từ 10 xuống còn 6 g/L và sucrose từ 30 xuống còn 20 g/L trong môi trường MS (từ đây được xem là MS cải tiến) và agar giảm từ 16 xuống 6 g/L với frutose thay thế cho sucrose trong môi trường Robert Ernst (từ đây xem là môi trường RE cải tiến, xem thêm Arditti, 1982). Để đánh giá ảnh hưởng từ việc giảm hàm lượng muối và thêm nước dừa (CW) như chất bổ sung, hạt đã thu hoạch được thử nghiệm trong 6 môi trường: (1) ½ MS cải tiến; (2) ½ MS bổ sung 10% CW; (3) ¼ MS cải tiến; (4) ¼ MS cải tiến với 10% CW; (5) RE cải tiến với 1.0 g/L thanh hoạt tính; (6) RE cải tiến với 1.0 g than hoạt tính và 10% CW. Tất cả môi trường đều được chỉnh về pH 5.8 sử dụng NaOH 1 mol/L hoặc HCl 1 mol/L. Mỗi nghiệm thức lặp lại 15 lần trong bình thủy tinh 200 mL vô trùng với 30 mL dung dịch môi trường/bình. Khoảng 100 hạt được khử trùng trong 5 phút với 1% NaOCl rồi đặt vào mỗi bình trong điều kiện vô trùng. Việc đưa các hạt lan vào bình được thực hiện bằng cách hòa hạt đã khử trùng vào dung dịch agar 0.1% đã được vô trùng bằng xilanh và bơm 1 mL vào mỗi bình. Sau khi đưa hạt vào bình, đếm số hạt trong mỗi bình. Hạt được nuôi cho nảy mầm ở phòng nuôi cấy mô trong chu kì sáng tối là 12/12 giờ. Chúng tôi sử dụng ánh sáng màu lạnh của đèn huỳnh quang với 200 µ mol m−2 s−1 cho chu kì sáng. Hạt lan nảy mầm và phát triển cây được chia thành 6 giai đoạn bao gồm cả giai đoạn chưa nảy mầm – giai đoạn 0 và được ghi nhận lại theo mô tả bởi Arditti (1967). Sự nảy mầm (giai đoạn 1), được định nghĩa là hạt vẫn còn vỏ, có màu trắng và xanh, được đánh giá sau 3 tháng gieo hạt (Arditti, 1967).
2.3 Đánh giá thứ phát về các điều kiện ánh sáng và các thử nghiệm phù hợp cho nảy mầm, hình thành và phát triển protocorm (giai đoại 1 – 3)
Theo như đánh giá sơ bộ ban đầu (xem phần kết quả), hai môi trường ¼ MS cải tiến bổ sung 10% CW và RE cải tiến với 1.0 g/L than hoạt tính và 10% CW, được lựa chọn để đánh giá ảnh hưởng ánh sáng (chu kì sáng tối 12/12 giờ so với chu kì 24 giờ tối) và thời gian khử trùng ( 1% [w/v] NaOCl khoảng 0, 40, 60 hoặc 80 phút) đối với sự nảy mầm, hình thành và phát triển protocorm. Một bộ hạt đã được khử trùng, 4 lần lặp lại cho mỗi nghiệm thức khử trùng, được đánh giá sức sống bằng sử dụng thử nghiệm FDA được mô tả như ở trên và so sánh với hạt không được khử trùng. Tất cả các thử nghiệm được quan sát dưới kính hiển vi huỳnh quang UV (LSM710, ImagerZ2, Zeiss, Đức). Một bộ hạt khác được chuyển vào môi trường sử dụng cùng phương pháp như trên, mỗi thử nghiệm lặp lại 15 chai (15 chai, mỗi chai 200 mL vô trùng chứa khoảng 100 hạt), hạt được cho nảy mầm trong cùng điều kiện phòng nuôi cấy như trên. Sau khi chuyển hạt vào chai, số lượng chính xác của hạt được đếm dưới kính hiển vi. Việc nuôi cấy với 24 giờ tối được thực hiện bằng cách bao bọc các chai nuôi cấy bằng vải đen. Hạt nảy mầm, hình thành và phát triển protocorm được đánh giá sau 40, 70 và 90 ngày gieo hạt. Chúng tôi định nghĩa sự hình thành protocorm (giai đoạn 2) là khi mở rộng phôi và nứt vỏ, phát triển protocorm (giai đoạn 3) là khi xuất hiện mô phân sinh non (promeristem) (Arditti, 1967).
2.4 Đánh giá môi trường phù hợp để hình thành cây con (giai đoạn 4)
Sau 90 ngày, các protocorm xanh đã phát triển trong các thử nghiệm trên được sử dụng để kiểm tra khả năng hình thành cây trong 4 môi trường: (1) ½ MS cải tiến với 0.2 mg/L indole-3-butylic acid (IBA) và 2.0 g/L than hoạt tính; (2) 3.0 g/L Hyponex No.1 (Hyponex Corporation, Mỹ) với 1.0 g/L NAA, 0.5 g/L than hoạt tính và 10% dịch chiết chuối; (3) MS cải tiến với 1.0 mg/L NAA, 0.2 mg/L IBA, 0.5 g than hoạt tính và 10% dịch chiết chuối; (4) 2.0 g/L Hyponex No.1 với 2.0 g/L peptone, 1.0 mg/L NAA, 1.0 g/L than hoạt tính và 10% dịch chiết chuối. Protocorm được chuyền sang chai 200 mL vô trùng trong điều kiện vô trùng và mỗi nghiệm thức có 15 chai, mỗi chai 3 protocorm. Protocorm được nuôi trong điều kiện 12 giờ sáng và 12 giờ tối. Sự hình thành cây con (giai đoạn 4), được định nghĩa là có lá đầu tiên xuất hiện (Arditti, 1967), được đánh giá sau 2 tháng sinh trưởng và sống sót của cây.
2.5 Đánh giá điều kiện phù hợp cho cây con tăng trưởng (giai đoạn 5)
Cây con đã phát triển được đánh giá sâu hơn trong giai đoạn tăng trưởng trong 6 môi trường: (1) MS cải tiến với 0.2 mg/L NAA, 2.0 mg/L 6-BA và 2.0 g/L than hoạt tính; (2) 3.0 g/L Hyponex No.1, 0.5 mg/L NAA và 1.0 g/L than hoạt tính; (3) 3.0 g/L Hyponex No 1, 2.0 mg/L 6-BA, 0.5 mg/L NAA và 1.0 g/L than hoạt tính; (4) MS cải tiến với 0.2 mg/L IBA, 0.2 mg/L 6-BA và 2.0 g/L than hoạt tính; (5) 3.0 g l−1 Hyponex No.1, 3.0 g/L peptone, 0.2 mg/L NAA, 2.0 mg/L 6-BA và 1 g/L than hoạt tính; (6) 3.0 g/L Hyponex No.1, 1.0 mg/L NAA, 1.0 mg/L 6-BA, 0.5 g/L than hoạt tính và 10% dịch chiết chuối. 3 cây con được chuyển vào mỗi chai 200 mL vô trùng trong điều kiện vô trùng và mỗi nghiệm thức lặp lại 8 chai. Ảnh hưởng của những môi trường này lên sự tăng trưởng của cây con (giai đoạn 5) được đánh giá thông qua tốc độ phát triển chiều dài và chiều rộng lá. Chúng tôi không đánh giá sinh khối bị hủy hoại bởi vì tất cả cây con đều được đưa về cho các thử nghiệm trong tự nhiên (hình 1g)
2.6 Đánh giá ảnh hưởng của nồng độ muối cao đến cấu trúc hạt và tính toàn vẹn tế bào
Khi kết thúc các thí nghiệm chúng tôi tiến hành các kiểm tra xa hơn bởi vì hạt có thể nảy mầm nhiều hơn đáng kể ở môi trường có nồng độ thấp hơn. Hạt được xử lý với 1% NaOCl khoảng 40 phút và rửa hai lần bằng nước khử ion tiệt trùng và được ngâm trong một trong 3 nghiệm thức sau: ¼ MS, MS và RE, mỗi nghiệm thức lập lại 4 lần. Sau 16 giờ ngâm, hạt được kiểm tra bằng thử nghiệm FDA được mô tả như ở trên và quan sát dưới kính hiển vi huỳnh quang UV (LSM710 ImagerZ2, Zeiss, Đức).
3. Phân tích thống kê
Chúng tôi không tiến hành phân tích thống kê đối với các thử nghiệm sơ bộ ban đầu về sự phù hợp thành phần môi trường cho nảy mầm (giai đoạn 1), bởi vì sự nảy mầm và hình thành protocorm chỉ diễn ra ở hai môi trường và cả hai môi trường này được lựa chọn để phân tích sâu hơn.
Bảng 1. Ảnh hưởng của thời gian khử trùng (với 1% NaOCl khoảng 0, 40, 60, và 80 phút), môi trường MS với 10% nước dừa [MSCW], Môi trường Robert Ernst (xem thêm Arditti, 1982) với 10% nước dừa [RECW], và ánh sáng ( 12/12 giờ sáng/tôi với 24 giờ tối) lên sự nảy mầm in vitro của loài Paphiopedilum spicerianum (Giá trị được thể hiện ở dạng thống kê Chi bình phương với mức ý nghĩa phù hợp). Sự nảy mầm của hạt được đánh giá sau 40, 70 và 90 ngày nảy mầm.
|
|
Số ngày sau khi gieo hạt (ngày |
|
40 |
70 |
90 |
Nhân tố
Thời gian khử trùng (df = 3) Môi trường (df = 1)
Ánh sáng (df = 1)
Thời gian khử trùng × Môi trường (df = 3)
Thời gian khử trùng × Ánh sáng (df = 3)
Môi trường × Ánh sáng (df = 1)
Thời gian khử trùng × Môi trường × Ánh sáng (df = 3) |
578.62*** 284.57*** 91.88*** 170.08*** 37.04*** 17.57**
0.12 ns |
1212.13*** 522.00*** 135.08*** 292.44*** 51.65*** 37.80*** 1.29 ns |
1219.90***522.08***137.60***304.03***49.14***36.35***
1.10 ns |
ns Không đáng kể.
** P < 0.01.
*** P < 0.0001.
Đối với những đánh giá thứ phát về điều kiện cho nảy mầm, hình thành và phát triển protocorm (giai đoạn 1 – 3), chúng tôi đếm số hạt mà đạt đến hoặc trải qua giai đoạn phát triển protocorm trong mỗi thử nghiệm, xem như thành công (mã hóa là 1). Những hạt không đạt đến giai đoạn này xem như thất bại (mã hóa là 0). Chúng tôi kiểm tra có phải môi trường, ánh sáng và thời gian khử trùng và tương tác giữa 3 nhân tố nhà làm ảnh hưởng đến xác suất thành công đạt đến hoặc trải qua giai đoạn hình thành protocorm hay không, bằng sử dụng mô hình tuyến tính tổng quát (Sileshi, 2012) với hàm phân phối nhị phân trong gói epicalc phần mềm R (version 3.1.1 R Development Core Team, 2011). Chúng tôi tiến hành so sánh để kiểm tra sự khác biệt sau khi điều chỉnh alpha ở 0.05 (Bretz và cộng sự, 2010) sử dụng Turkey test trong gói mvtnorm và multcomp của phầm mềm R.
Bởi vì sự hình thành cây (giai đoạn 4) chỉ thành công ở một trong 4 môi trường thử nghiệm nên chúng tôi không tiến hành phân tích thống kê đánh giá điều kiện thích hợp cho phát triển cây. Đối với đánh giá điều kiện phù hợp cho sự tăng trưởng của cây, chúng tôi tính toán tốc độ phát triển chiều dài lá tương đối (RLLGR): RLLGR = (LLn/LL0)/t, trong đó LLo là chiều dài lá của cây tại thời điểm kết thúc đo đạc và LLn là chiều dài lá tại thời điểm kết thúc thí nghiệm, và t là thời gian trôi qua. Tốc độ tăng trưởng chiều rộng lá tương đối được tính toán theo (RLWGR): RLWGR = (LW n/LW 0)/t, trong đó LWo là chiều rộng lá của cây tại thời điêm đo cuối cùng, LWn là chiều rộng lá tại thời điểm kết thúc thí nghiệm, t là thời gian trôi qua. Đối với phân tích sử dụng RLLGR và RLWGR như là biến đáp ứng, chúng tôi sử dụng mô hình hồi quy tuyến tính hỗn hợp tổng quát cho các dữ liệu không cân bằng (vài thử nghiệm bị nhiễm nấm và phải bỏ đi) sử dụng gói Ime4 trong R, trong đó môi trường là yếu tố cố định còn sự lặp lại của các chai có sự tăng trưởng là yếu tố ngẫu nhiên. Trong khuôn khổ của mô hình được bố trí, bậc tự do đơn được tính toán bằng Turkey test điều chỉnh (alpha = 0.05) để so sánh giữa các môi trường, sử dụng gói mvtnorm và multcomp của phần mềm R.
4. Kết quả
4.1 Vật liệu từ cây P. spicerianum và lựa chọn hạt giống
Các thử nghiệm kiểm tra sức sống đối với hạt tươi cho thấy trung bình 51.5 ± 6.3% hạt chứa phôi có khả năng sống, được đánh giá thông qua sự phát huỳnh quang xanh trong tế bào sống trong vỏ và phôi.
4.2 Đánh giá sơ bộ về các thành phần môi trường phù hợp cho sự nảy mầm (giai đoạn 1)
Trong những thử nghiệm sơ bộ ban đầu sử dụng 6 môi trường chúng tôi có thể cho hạt nảy mầm đầy đủ trong môi trường ¼ MS bổ sung 10% CW (79 ± 8% hạt nảy mầm), và môi trường RE cải tiến với 1.0 g/L than hoạt tính và 10% CW (57 ± 8% hạt nảy mầm). Tất cả môi trường RE còn lại đều làm cho hạt nảy mầm nhưng sau đó lại chết đi và tất cả môi trường MS còn lại đều cho tỉ lệ nảy mầm thấp hơn khi so sánh với môi trường ¼ có 10% CW.
4.3 Đánh giá thứ phát về các điều kiện ánh sáng và các thử nghiệm phù hợp cho nảy mầm, hình thành và phát triển protocorm (giai đoại 1 – 3)
Khi chúng tôi đánh giá sâu hơn về sự nảy mầm trên hai môi trường đã nêu ở trên, chúng tôi phát hiện rằng ở 40 ngày sau khi nảy mầm, tất cả 3 nhân tố - thời gian khử trùng, môi trường và ánh sáng – đều có ảnh hưởng đáng kể đến xác suất nảy mầm (bảng 1). Thời gian khử trùng là yếu tố ảnh hưởng đáng kể nhất đễn xác suất nảy mầm theo sau là môi trường và ánh sáng (P < 0.0001; bảng 1, Hình 2).
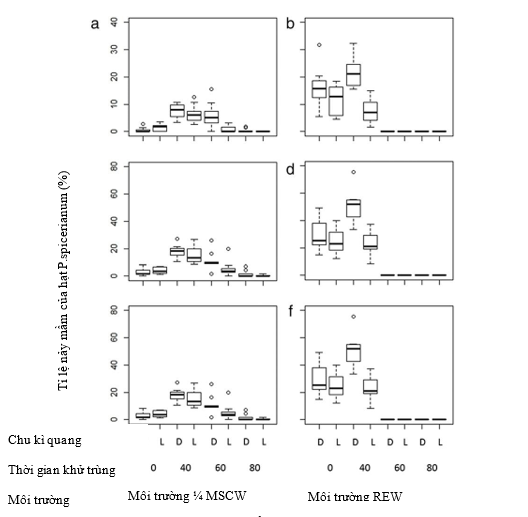
Hình 2. Phần trăm hạt P. spicerianum hạt nảy mầm đánh giá sau 40, 70 và 90 ngày bắt đầu thí nghiệm. Chu kì quang: D = hạt nảy mầm trong chu kì 24 giờ tối và L = hạt nảy mầm trong 12 sáng và 12 giờ tối. ¼ MSCW = ¼ MS cải tiến bổ sung 10% nước dừa, và RECW = Môi trường Robert Ernst bổ sung 10% nước dừa. Hình a và b cho thấy tỉ lệ nảy mầm sau 40 ngày, hình c và d là tỉ lệ nảy mầm sau 70 ngày và hình e và f là tỉ lệ nảy mầm sau 90 ngày. Đường kẻ đen dày trong mỗi khung trên biểu đồ chỉ ra giá trị 50% của mỗi loài, đường kẻ thấp hơn và cao hơn đại diện cho 25 và 75%, thanh sai số là 10 và 90%. Đường kẻ trên hoặc dưới 10 và 90% đại diện cho điểm dữ liệu được lặp lại hơn 3 lần so với sai số chuẩn quan sát ( các đường viền bên ngoài)
Có những tương tác rõ rệt giữa các yếu tố ( thời gian khử trùng và môi trường, P < 0.0001; thời gian khử trùng và ánh sáng P < 0.0001; môi trường và ánh sáng P < 0.01; Bảng 1). Mặc dù tỉ lệ nảy mầm cao nhất được quan sát thấy trong môi trường RECW với thời gian khử trùng 40 bằng 1 % NaClO và giữ trong bóng tối (21.65 ± 1.88 % hạt nảy mầm; Hình 2b), tất cả protocorm có màu trắng sau đó chuyển sang nâu và chết đi (hình 2ba) và xem hình ảnh để so sánh trong Hình 3. Trong MSCW, cùng điều kiện cho tỉ lệ nảy mầm cao nhất (7.50 ± 0.75% hạt nảy mầm, hình 2a) cho tất cả môi trường này, nhưng hạt đã nảy mầm phát triển thêm thành protocorm màu xanh khỏe mạnh, hình 3, không giống như trên môi trường RECW, hình 2b. Ở 40 ngày, khi điều kiện có ánh sáng so sánh với điều kiện tối, xác suất nảy mầm cao hơn đáng kể trong điều kiện tối, đối với hạt được khử trùng khoảng 60 phút nuôi trong MSCW và khoảng 40 phút cho hạt nuôi trong RECW (bảng 2). Khi khử trùng khoảng 60 phút với 1% NaOCl, không hạt nào nảy mầm trên RECW trong điều kiện tối cũng như chu kì 12/12 giờ sáng/tối. Hạt được khử trùng khoảng 80 phút với 1% NaOCl không nảy mầm trên bất kì môi trường nào.
Khi nảy mầm được đánh giá ở 70 ngày, hạt được xử lý với NaOCl cho thấy không có sự khác biệt giữa các điều kiện sáng tối khác nhau, nhưng tỉ lệ nảy mầm rất thấp 0.97 ± 0.42% hạt nảy mầm cho cả hạt trong tối và sáng, hình 2c,d). Ngược lại hạt nảy mầm cao hơn trong bóng tối khi khử trùng 40 phút với 1% NaOCl (16.37 ± 4.94% trong MSCW và 50.25 ± 17.76% trong RECW). Khi hạt nảy mầm được đánh giá ở 90 ngày, kết quả tương tự như 70 ngày (Bảng 1 và 2, Hình 2e, f). Trong điều kiện tối với 40 phút khử trùng bằng NaOCl 1%, môi trường MSCW có 18.05 ± 5.44% hạt nảy mầm so sánh với 51.02 ± 18.04% trong RECW.

Hình 3. So sánh sự nảy mầm giữa hai môi trường. (a) Hình thành chồi xanh từ protocorm 70 ngày tuổi nảy mầm trong ¼ MS với 10% nước dừa. (b) Protocorm 70 ngày tuổi và đã chết trong môi trường Robert Ernst bổ sung 10% nước dừa.
Bảng 2. Ảnh hưởng của điều kiện sáng và tối lên xác suất nảy mầm ở Paphiopedilum spicerianum , hạt nảy mầm trên MS (1962) bổ sung 10% nước dừa (MSCW) và Robert Ernst (xem thêm Arditti, 1982) bổ sung với 10% nước dừa (RECW) (số liệu ± SE) cho các thời gian khử trùng khác nhau (rửa với 1% NaOCl khoảng 0, 40, 60 và 80 phút). Sự nảy mầm được đánh giá ở 40, 70 và 90 ngày sau khi nảy mầm. So sánh mỗi thời gian khử trùng vói điều kiện ánh sáng (kết quả âm “-“ cho thấy xác suất hình thành protocorm trong điều kiện tối cao hơn so với khi có ánh sáng). Chúng tôi cung cấp số liệu và sai số chuẩn của chúng, và mối quan hệ giữa các yếu tố được so sánh khi sử dụng giá trị P điều chỉnh và phương pháp so sánh Turkey.
|
|
Ngày sau khi gieo (ngày) |
|
|
40 |
70 |
90 |
|
Môi trường MSCW |
|
|
|
|
Thời gian khử trùng (phút) |
|
|
|
|
0 |
0.87 ± 0.67 ns |
0. 0.39 ± 0.38 ns |
0.37 ± 0.38 ns |
|
40 |
-0.21 ± 0.20 ns |
-0.15 ± 0.14 ns |
-0.21 ± 0.14 ns |
|
60 |
-1.78 ± 0.36*** |
-0.91 ± 0.21** |
-0.80 ± 0.20** |
|
80 |
ng |
-1.32 ± 0.78 ns |
-1.32 ± 0.78 ns |
|
Môi trường RECW |
|
|
|
|
Thời gian khử trùng (phút) |
|
|
|
|
0 |
-0.35 ± 0.15 ns |
-0.22 ± 0.12 ns |
-0.23 ± 0.12 ns |
|
40 |
-1.19 ± 0.17*** |
-1.25 ± 0.12*** |
-1.27 ± 0.12*** |
|
60 |
ng |
ng |
ng |
|
80 |
ng |
ng |
ng |
Thử nghiệm của FDA đã giúp hiểu rõ hơn về lý do tại sao hạt đã được xử lý 60 phút hoặc 80 phút với 1% NaOCl không nảy mầm trong khi hạt 40 phút lại nảy mầm thành công hơn. Hình ảnh chụp bằng UV so sánh với các hạt không xử lý hóa chất (hình 4a), hạt xử lý khoảng 40 phút với 1% NaOCl đã làm tan tế bào vỏ ở phần dài cuối hạt, nhưng tế bào vỏ bao quanh phôi vẫn còn nguyên vẹn và phôi vẫn còn sống (hình 4b). Hạt xử lý khoảng 60 phút với NaOCl, quan sát thấy vỏ đã nứt ra và gần 50% phôi không sống được. Trong thời gian xử lý khoảng 80 phút, phôi đã trồi ra ngoài vỏ, nhiều tế bào phôi bị chết và hầu như tất cả các phôi đều không sống được.
4.4 Đánh giá môi trường phù hợp để hình thành cây con (giai đoạn 4)
Trong 4 môi trường thử nghiệm, cây hình thành chỉ trên môi trường có 3.0 Hyponex No.1 với 1.0 mg/L NAA, 0.5 g/L than hoạt tính với 10% dịch chiết chuối (hình 1 e và f cho thấy cây phát triển sau 1 và 3 tháng). Tất cả các nghiệm thức có protocorm 90 ngày tuổi đều chuyển sang nâu và chết đi.
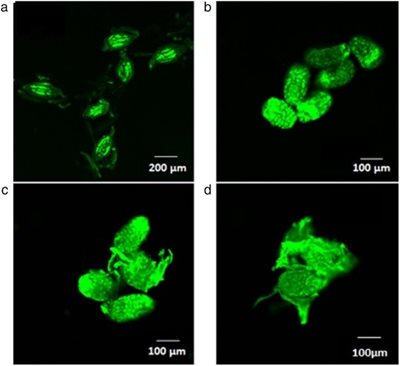
Hình 4. So sánh hạt trong các thời gian xử lý khác nhau với 1% NaOCl sau đó nhuộm với Fluorescent Diacetate, (a) Hạt không xử lý, (b) Hạt xử lý khoảng 40 phút, (c) Hạt xử lý khoảng 60 phút và (d) Hạt xử lý khoảng 80 phút
4.5 Đánh giá điều kiện phù hợp cho cây con tăng trưởng (giai đoạn 5)
Sự tăng trưởng của cây chịu ảnh hưởng đáng kể bởi thành phần môi trường, xác định thông qua tốc độ phát triên chiều dài lá (F5,36 = 3.652, P < 0.01). Tốc độ phát triên chiều dài lá cao nhất và lá vẫn có màu xanh ở môi trường có 3.0 g/L Hyponex, 1.0 mg/L NAA, 1.0 mg/L 6-BA, 0.5 g/L than hoạt tính và 10% dịch chiết chuối, so sánh với môi trường có 3.0 g/L Hyponex, 3.0 g/L peptone, 0.2 mg/L NAA, 2.0 mg/L 6-BA và 1 g/L than hoạt tính hoặc môi trường MS cải tiến với 0.2 mg/L NAA, 2.0 mg/L 6-BA và 2.0 g/L than hoạt tính. Tất cả môi trường còn lại đều khác nhau đáng kể và cho tốc độ phát triển chiều dài lá thấp hơn khi so sánh với môi trường 3.0 g/L Hyponex, 1.0 mg/L NAA, 1.0 mg/L 6-BA, 0.5 g/L than hoạt tính và 10% dịch chiết chuối (P < 0.05). Ba môi trường đầu tiên đều cho lá vàng nhưng cây con vẫn sống cho đến 6 tháng sau. Trong tất cả môi trường, chúng tôi thấy có trung bình 3 đến 4 chồi trên mỗi cụm chồi từ hạt nảy mầm.
Thử nghiệm FDA cho thấy hạt được xử lý 16 giờ trong ¼ MS có hạt khỏe (hình 6a), trong khi đó hạt trên môi trường MS có dấu hiệu co lại (Hình 6b). Hạt xử lý với RE, chúng tôi thấy, gần 50% tế bào phôi bị chết (hình 6c)
5. Kết luận
Việc lựa chọn môi trường, điều kiện về thời gian sinh trưởng và xử lý hóa chất có ảnh đáng kể đến sự nảy mầm của hạt P. spicerianum. Theo như các báo cáo cho các loài Paphiopedilum khác (Pierik và cộng sự, 1988; Chen và cộng sự, 2004a,b; Ding và cộng sự, 2004; Long và cộng sự, 2010; Zeng và cộng sự, 2012), các thử nghiệm ban đầu về sự nảy mầm đã khẳng định rằng P. spicerianum nảy mầm tốt nhất trong điều kiện ít muối khoáng. Môi trường lý tưởng cho hạt của loài Paphiopedilum nảy mầm tùy thuộc vào đặc tính mỗi loài.
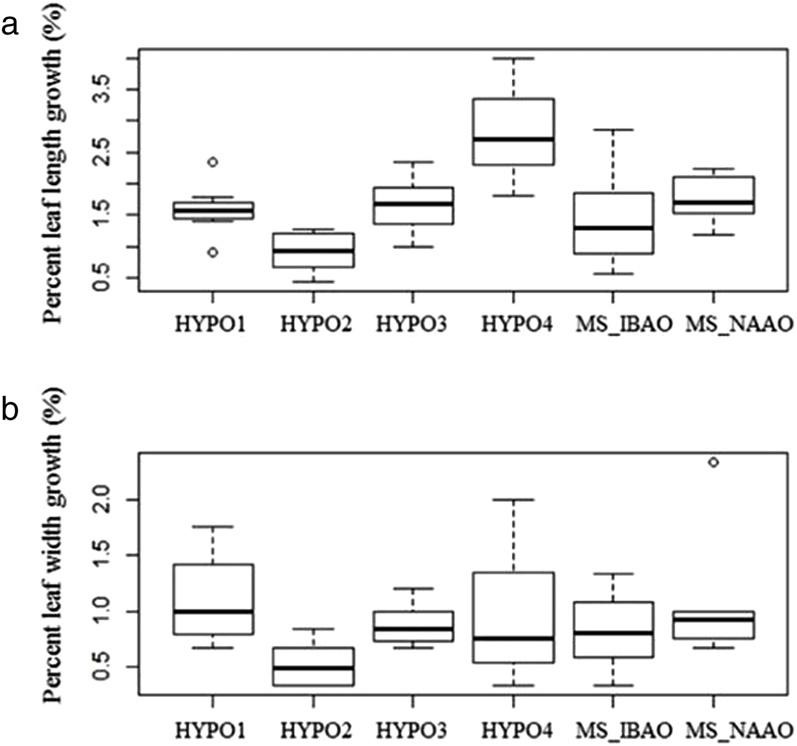
Hình 5. Sự tăng trưởng của cây được đánh giá bằng sự phát triển chiều dài và chiều rộng của lá dài nhất trong mỗi môi trường. Môi trường: 3.0 g/L Hyponex No 1, 0.5 mg/L NAA và 1.0 g/L than hoạt tính (HYPO1); 3.0 g/L Hyponex No 1, 2.0 mg/L 6-BA, 0.5 mg/L NAA và 1.0 g/L than hoạt tính (HYPO2); 3.0 g/L Hyponex No 1, 3.0 g/L peptone, 0.2 mg/L NAA, 2.0 mg/L 6-BA và 1 g/L than hoạt tính (HYPO3); 3.0 g/L Hyponex No 1, 1.0 mg/L NAA, 1.0 mg/L 6-BA, 0.5 g/L than hoạt tính và 10% dịch chiết chuối (HYPO4); MS cải tiến với 0.2 mg/L IBA, 0.2 mg/L 6-BA và 2.0 g/L than hoạt tính (MS-IBAO) và MS cải tiến với 0.2 mg/L NAA, 2.0 mg/L 6-BA và 2.0 g/L than hoạt tính (MS-NAAO). (a) Sự phát triển chiều dài lá tỉ lệ với những đo đạc ban đầu. (b) Sự phát triển chiều rộng lá tỉ lệ với những đo đạc ban đầu.
Đường kẻ đen dày trong mỗi khung trên biểu đồ chỉ ra giá trị 50% của mỗi loài, đường kẻ thấp hơn và cao hơn đại diện cho 25 và 75%, thanh sai số là 10 và 90%. Đường kẻ trên hoặc dưới 10 và 90% đại diện cho điểm dữ liệu được lặp lại hơn 3 lần so với sai số chuẩn quan sát (các đường viền bên ngoài).
Thành phần của môi trường có thể thay đổi theo Môi trường Thomale GD cải tiến (Paphiopedilum hybrids; Flamee, 1978 cf. Zeng và cộng sự, 2012), Knudson C (KC; P. delenaii; Nhut và cộng sự, 2005), 1/4 MS (P. ciliolare; Pierik và cộng sự, 1988), 1/2 MS (P. wardii; Zeng và cộng sự, 2012). Hơn nữa, thậm chí cho cùng loài, P. micranthum, có vài báo cáo về môi trường khác tạo điều kiện tốt nhất cho nảy mầm ( Môi trường RE; Chen và cộng sự, 2004a,b; 1/5 MS; Ding và cộng sự, 2004).
Trong những thử nghiệm sâu hơn của chúng tôi về môi trường phù hợp cho nảy mầm, chúng tôi nhận thấy rằng thông qua prototocorm P. spicerianum được hình thành trong môi trường có nồng độ muối khoáng thấp ¼ MS, nhưng số lượng hạt nảy mầm trong môi trường ¼ MS ít hơn trong môi trường RE. Điều này tương tự như những gì Pierik và cộng sự (1988) tìm thấy khi so sánh KC và ¼ MS; KC cho số lượng hạt nảy mầm cao hơn nhưng hạt lại chết mà không phát triển nữa. KC có thành phần tương tự như RE và hạt giống vẫn giữ màu trắng khi phát triển trên môi trường RE, không phát triển chlorophyll và sau đó chuyển sang nâu và chết. Điểm khác biệt chính giữa MS với cả KC và RE là có nhiều vi lượng hơn cần thiết cho sự phát triển của cây.
Khi chúng tôi đánh giá cấu trúc hạt và sức sống của tế bào phôi bằng thử nghiệm FDA, chúng tôi thấy rằng hạt trong môi trường ¼ MS vẫn giữ được tính nguyên vẹn của chúng, trong khi đó môi trường MS làm cho hạt co lại (Hình 6). Kết quả này cho thấy môi trường MS có nồng độ chất tan quá cao cho P. spicerianum, dẫn đến chất tan đi vào trong hạt. Mặc dù chúng tôi không thấy sự co lại đối với hạt trong xử lý trong RE, nhưng chúng tôi quan sát thấy sự chết tế bào cục bộ trong phôi trong những hạt này, có thể nhìn thấy như không gian màu đen trong phôi, cho thấy các thành phần của môi trường RE có thể độc hại đối với một số tế bào phôi. Có một số điều chưa rõ ràng trong nghiên cứu này, rằng tại sao hay nhân tố nào trong môi trường RE đã gây ra sự chết tế bào và điều này nên được nghiên cứu sâu hơn. Tuy nhiên, bởi vì hạt trong môi trường RE đã bị phồng lên và chuyển sang màu trắng, nhưng chúng lại không phát triển thành tế bào xanh, nên chúng tôi cho rằng chất độc có thể ảnh hưởng đến sự hình thành chlorophyll sau khi tế bào nở ra.
Theo những gì chúng tôi biết về các loài Paphiopedilum khác, hàm lượng muối khoáng thấp không chỉ là yếu tố duy nhất có ảnh hưởng đến sự nảy mầm và sự phát triển của protocorm. Chu kì quang và thời gian xử lý hóa chất khử trùng có ảnh hưởng đáng kể đến xác xuất nảy mầm. Chúng tôi thấy rằng, ngoại trừ hạt không được xử lý hóa chất và hạt được xử lý khoảng 40 phút và nảy mầm trên môi trường MSCW, trong các nghiệm thức có hạt nảy mầm khác nếu có chu kì quang 24 giờ tối sẽ làm tăng xác suất nảy mầm so với chu kì quang sáng tối 12/12 giờ. Pierik và cộng sự (1988) báo cáo rằng có mỗi tương quan âm giữa sự nảy mầm và sự gia tăng cường độ chiếu sáng đối với hạt P. ciliolare. Chúng tôi thấy rằng nghiệm thức có 24 giờ tối trong 30 ngày cho kết quả hạt nảy mầm cao nhất đối với P. ciliolare. Zeng và cộng sự (2012) báo cáo rằng thời gian của thử nghiệm tối có ảnh hưởng đáng kể đến tỉ lệ nảy mầm; hạt xử lý tối trong 45 ngày có tỉ lệ nảy mầm cao nhất. Những nghiên cứu báo cáo rằng môi trường nuôi cấy có thể điều chỉnh ảnh hưởng của ánh sáng lên sự nảy mầm. Stimart và Ascher (1981) báo cáo rằng môi trường Thomale GD cải tiến trong tối thúc đẩy mạnh mẽ hạt nảy mầm cũng như sự sống sót protocorm giống lai Paphiopedilum, trong khi đó sự nảy mầm tốt nhất là trong môi trường Burgett EG-1 khi có ảnh sáng mặc dù về sau hạt bị chết đi. Nghiên cứu của Zeng và cộng sự (2012) báo cáo rằng xử lý tối liên tục lên hạt sẽ không hình thành cây con, cho thấy rằng ánh sáng là một ý nghĩa sinh thái quan trọng trong việc phát triển cây con, mặc dù không rõ lý do tại sao việc xử lý tối thúc đẩy nảy mầm hạt địa lan. Người ta thừa nhận rằng các loài phong lan cần ánh sáng để nảy mầm trong khi đó các loài địa lan lại cần điều kiện tối. Tuy nhiên, đây là hiện tượng phức tạp và kết quả của chúng tôi và những người khác cho thấy rằng nhu cầu ánh sáng cho sự nảy mầm của chi Paphiopedilum đặc trưng cho từng loài và từng giai đoạn nảy mầm.
Cho nảy mầm in vitro ở hạt lan chín có thể thất bại bởi vì cơ chế cơ học hoặc sinh lý làm cho hạt duy trì trạng thái ngủ. Trạng thái ngủ của hạt có thể bị phá vỡ bởi các chế độ nhiệt độ nhất định, sự hấp thụ kéo dài, làm mềm hóa vỏ với Ca(OCl)2 hoặc NaOCl, hoặc do phá hỏng cơ học (Zeng và cộng sự, 2013). Những nghiên cứu về nảy mầm hạt lan đã cho thấy hạt còn non nảy mầm tốt hơn hạt trưởng thành bởi vì lớp vỏ càng trưởng thành càng khó thấm nước (Ramsay và Stewart, 1998; Kauth và cộng sự, 2008). Tuy nhiên điều này còn tùy theo loài, đối với Cypripedium debile, một loài cùng phân họ với Paphiopedilum, hạt trưởng thành nảy mầm tốt hơn so với hạt còn non bởi vì lớp tế bào biểu bì ở vỏ sắp xếp thưa thớt làm cho vỏ ít kị nước hơn (Hsu và Lee, 2012). Đối với chi Paphiopedilum, ảnh hưởng của sự trưởng thành của vỏ hạt, được đo bằng số lượng ngày sau khi thụ phấn (DAP), được biết là rất khác nhau. Ở P. godefroyae, thời gian tối ưu là 90 đến 120 ngày (Lee, 2007), trong khi đó P. villosum var. Densissimum DAP từ 170 đến 190 ngày (Long và cộng sự, 2010). Trong nghiên cứu này của chúng tôi, chúng tôi không thể kiểm tra thành công ảnh hưởng của độ trưởng thành của hạt lên sự nảy mầm bởi vì chúng tôi chỉ có hai quả có hạt từ quần thể rất nhỏ P. spicerianum, và tất cả các thí nghiệm đều được tiến hành ở hạt 365 DAP. Nghiên cứu trước đây của Lee (2007), hạt của P. spicerianum lấy từ nhà kính cho 40-50% nảy mầm khi sử dụng hạt 120-180 DAP. Nảy mầm tốt nhất trong nghiên cứu này là ở 90 ngày với tỉ lệ trung bình là 18.05 ± 5.44%. Vì vậy, hạt càng non thì tỉ lệ nảy mầm càng cao.
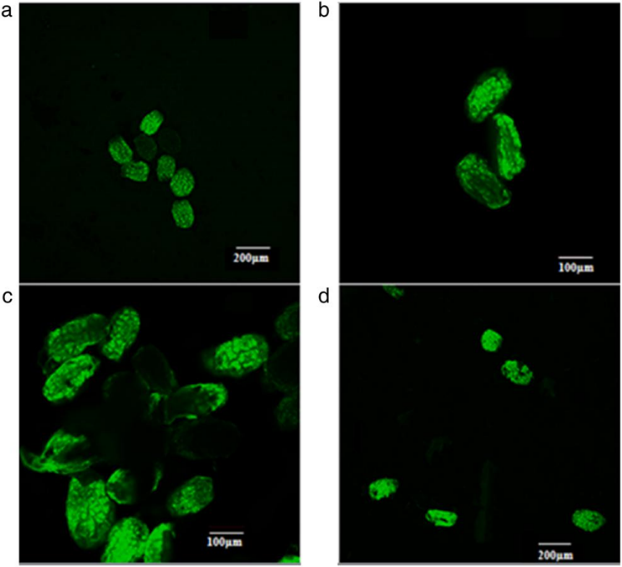
Hình 6. Cấu trúc hạt và đánh giá tế bào sau khi ngâm trong các môi trường khác nhau và nhuộm bằng fluorescent diacetate . a. Hạt ngâm trong dung dịch 1/4 MS , b. Hạt ngâm với dung dịch MS, c và d. Hạt ngâm trong dung dịch RE. Tất cả các hạt đã được xử lý với 1% NaOCl trong 40 phút trước khi ngâm trong mỗi dung dịch môi trường.
Tác dụng kích thích của NaOCl hoặc Ca (ClO) 2 trên hạt Paphiopedilum cũng đặc trưng cho từng loài và thời gian tối ưu cho việc xử lý hạt có thể dao động từ 10 đến 75 phút (Liao và Chen, 2006 cf. Lee, 2007; Zeng và cộng sự, 2012). Lee (2007) cho thấy rằng hạt Paphiopedilum xử lý từ 40-80 phút có tỉ lệ nảy mầm cải thiện, trong khi Zeng và cộng sự (2012) báo cáo rằng P. wardii xử lý 1% NaOCl trong khoảng 40 phút hoặc 0.5% NaOCl khoảng 60 phút sẽ làm gia tăng đáng kể sự nảy mầm Trong cả hai nghiên cứu, nồng độ NaOCl mạnh hơn và thời lượng kéo dài hơn đã ức chế sự nảy mầm. Chúng tôi cũng thấy rằng xử lý 40 phút với 1% NaOCl là tốt nhất để có được sự nảy mầm và phát triển protocorm khả thi trên hạt giống có từ quả 356 DAP của P.spicerianum. Các hình ảnh chụp bởi UV trong thử nghiệm FDA đối với các hạt đã được xử lý trước bằng NaOCl đã cho thấy rằng hạt đã được xử lý trong thời gian lâu hơn có thể sẽ mất đi tính toàn vẹn của vỏ và gây chết tế bào phôi (Hình 3). Điều này giải thích tại sao sự nảy mầm thấp hơn hoặc không có trong các hạt được xử lý trong thời gian dài hơn 40 phút. Do đó, nghiên cứu của chúng tôi cũng ủng hộ giả thuyết rằng các tế bào vỏ hạt sống có thể rất quan trọng trong việc cung cấp dinh dưỡng và kích hoạt tế bào phôi cho sự phát triển protocorm (Zeng và cộng sự, 2013).
Tăng cường môi trường với các chất điều chỉnh tăng trưởng thực vật, carbohydrate cung cấp nguồn năng lượng, các chất bổ sung hữu cơ kích thích sự phát triển và các vitamin có lợi, tất cả được cho là thuận lợi trong quá trình hình thành và tăng trưởng tế bào dị dưỡng của cây lan (Arditti, 1967, 1982; Kauth và cộng sự , 2008). Tương tự như những gì chúng tôi tìm thấy trong P. spicerianum, Zeng và cộng sự (2012) cũng tìm thấy trong P. wardii rằng môi trường Hyponex bổ sung với dịch chiết chuối là thích hợp nhất cho việc hình thành cây con. Dịch chiết chuối có thể thúc đẩy sự hình thành cây con vì bổ sung các chất dinh dưỡng và đủ lượng đường cung cấp cho môi trường. Trong khi Zeng và cộng sự (2012) đã sử dụng peptone như một chất điều chỉnh tăng trưởng thực vật, thì trong nghiên cứu của chúng tôi cùng một môi trường với peptone thêm vào, lại không hình thành cây con. Tương tự P. wardii, P. spicerianum phản ứng tốt với việc bổ sung NAA để thúc đẩy sự phát triển của rễ, và than hoạt tính rất quan trọng để hấp thụ các hóa chất độc hại được tạo ra trong quá trình tạo cây con. Ngược lại, Long và cộng sự (2010) nhận thấy trong bốn loài Paphiopedilum sự bổ sung của NAA và BA đã tạo thành lá xanh, nhưng các lần cấy chuyền cây con về sau đã không thành công. Long và cộng sự cũng chỉ ra rằng không có sự thống nhất trong việc nhân giống chồi khi nồng độ NAA và BA khác nhau (Long và cộng sự, 2010). Trong nghiên cứu của chúng tôi, môi trường MS cơ bản giống nhau thì tốt cho sự nảy mầm hạt nhưng lại không thành công trong sự hình thành cây con. Tóm lại, kết quả của chúng tôi và các nghiên cứu trước đây về các loài Paphiopedilum chỉ ra rằng môi trường tốt nhất cho việc hình thành cây con phải được xác định riêng cho từng loài nghiên cứu.
Khi chúng tôi đánh giá sự tăng trưởng của cây con, chúng tôi thấy rằng cùng một môi trường hỗ trợ sự hình thành cây con, chứa 3.0 g/L Hyponex No 1, 1.0 mg/L NAA, 0.5 g/L than hoạt tính và 10% dịch chiết chuối là tốt nhất cây con tăng trưởng, nhưng với điều kiện bổ sung thêm 1.0 mg/L 6-BA. BA được biết đến để thúc đẩy sự hình thành lá cây ở các loài Paphiopedilum khác nhưng ở các nồng độ khác nhau (Huang và cộng sự, 2001). Trong nghiên cứu của chúng tôi, ba môi trường đã được thử nghiệm về tốc độ tăng trưởng của thân cây non đã bị thất bại. Trong ba môi trường còn lại, lá có màu vàng nhưng cây con vẫn còn sống ngay cả khi kết thúc 4 tháng. Trong nghiên cứu của chúng tôi, chúng tôi thu được trung bình ba đến bốn chồi trên mỗi hạt nảy mầm. Tuy nhiên, trong hầu hết các trường hợp Paphiopedilum sản xuất ít chồi trên mỗi đốt (Chen và cộng sự, 2004a, b, Hong và các cộng sự, 2008).
Giới hạn chính của nghiên cứu này là sự sẵn có của hạt giống đối với thí nghiệm. Đây là một khó khăn không thể tránh khỏi khi làm việc với PSESPs. Trong cách tiếp cận của chúng tôi để phát triển sự nảy mầm hạt giống, sự hình thành và phát triển cây con, chúng tôi đã sử dụng nhiều môi trường có chứa các thành phần và nồng độ khác nhau dựa trên kinh nghiệm của chúng tôi về các loài cùng chi này, liên lạc với các chuyên gia trong lĩnh vực này và dựa vào các tài liệu đã xuất bản. Sẽ là một ý tưởng hay nếu phát triển các quy trình của chúng tôi ở cách tiếp cần từng bước và hợp lý hơn. Những hạn chế khác bao gồm việc không biết cây con được sinh ra sống sót như thế nào trong tự nhiên; các thí nghiệm tiếp theo sẽ kiểm tra điều này (xem hình 1. g, cây con được trồng vào trong đất , sẵn sàng để đưa về tự nhiên). Zeng và cộng sự (2012) đã có thể đưa về tự nhiên thành công một loài Paphiopedilum khác, chứng tỏ rằng phương pháp này có thể thành công trong việc phát triển cây con để trả về tự nhiên. Chúng tôi cũng đã không kiểm tra ảnh hưởng của sự trưởng thành của vỏ quả đối với sự nảy mầm của hạt (Lee, 2007). Cuối cùng, các thí nghiệm của chúng tôi được tiến hành trên các hạt giống thu được từ một quần thể đơn và so sánh các quy trình không cộng sinh với các quần thể khác ở miền bắc Ấn Độ và Myanmar (Liu và cộng sự, 2009) được khuyến khích, vì các quần thể khác nhau có thể có sự khác biệt về nhu cầu nảy mầm và tăng trưởng do sự thích ứng địa phương. Mặc dù có những hạn chế này nhưng chúng tôi đã đưa ra được lộ trình đầu tiên về sự nảy mầm của một trong những loài địa lan dễ bị tổn thương nhất thế giới mà có tiềm năng về trồng trọt cao. Các loài có quy mô quần thể nhỏ có xu hướng biến động theo nhóm ngẫu nhiên dẫn đến sự tuyệt chủng (Purvis và cộng sự, 2000, Melbourne và Hastings, 2008). Vì vậy, đây là thời điển quan trọng và nhạy cảm để phát triển phương pháp bảo tồn tổng hợp cho loài P. spicerianum. Cho nảy mầm in vitro là một phương pháp thuận lợi cho việc sản xuất cây trồng quy mô lớn, có thể được sử dụng để trả về tự nhiên, cũng như nhân giống thương mại, do đó làm giảm áp lực thu hái quần thể hoang dã.
6. Kết luận
Dựa vào nghiên cứu của chúng tôi, chúng tôi đưa ra những khuyến cáo sau đây để tăng cường sự nảy mầm của hạt và có được sự phát triển protocorm đối với các loài này: tiền xử lý quả giống được thực hiện với NaOCl 1% trong khoảng 40 phút và hạt giống cần được nảy mầm trong chu kì quang là 24 giờ tối trong khoảng 30 ngày trong 1/4 MS cải tiến bằng cách làm giảm agar đến 6 g/L và sucrose đến 20 g/L và bổ sung 10% nước dừa. Đối với sự hình thành cây con, chúng tôi khuyến cáo nên sử dụng protocorm 90 ngày tuổi trong 3.0 g/L Hyponex No 1 với 1.0 mg/L NAA, 0.5g/L than hoạt tính và 10% dịch chiết cuối chuối, nuôi trong 6 tháng trước khi chuyển sang môi trường để tăng trưởng cho cây. Đối với quá trình tăng trưởng cây, chúng tôi khuyến cáo sử dụng các môi trường tương tự với tạo cây giống, có bổ sung 1.0 mg/L 6-BA. Chúng tôi kết luận rằng thử nghiệm của FDA có hiệu quả có thể được sử dụng để sàng lọc một số lượng nhỏ các hạt giống để khử trùng và tìm ra môi trường thích hợp cho cho phát triển. Việc sàng lọc như vậy là rất quan trọng đối với sự nảy mầm của các loài quý hiếm và có nguy cơ tuyệt chủng bởi vì chúng có số lượng hạt giống hạn chế để thử nghiệm và phát triển các quy trình.
Lời cảm ơn
Nghiên cứu này được Quỹ khoa học tự nhiên quốc gia Trung Quốc hỗ trợ (số 31170358) cho J.Y. Gao và bản thảo đã được Quỹ khoa học sau Tiến sĩ Trung Quốc năm 2013 (2013M531997 và 2014T70894) hỗ trợ tài chính cho U.M. Goodale. Chúng tôi rất biết ơn Phòng thí nghiệm Trung ương XTBG về sự trợ giúp kỹ thuật bằng kính hiển vi điện tử quét và gửi lời cảm ơn đến Q. Liu vì đã thu thập hạt giống. Chúng tôi cảm ơn Tiến sĩ Richard Corlett và Tiến sĩ Eben Goodale đã biên tập và cung cấp các ý kiến có giá trị về bản thảo này.
Tài liệu tham khảo
Arditti, J., 1967. Factors affecting the germination of orchid seeds. Bot. Rev. 33, 1–97.
Arditti, J., 1982. Orchid Biology: Reviews and Perspective II. Cornell University, Ithaca, NY.
Bretz, F., Hothorn, T., Westfall, P., 2010. Multiple Comparisons Using R. Chapman and Hall, CRC, Boca Raton.
Chen, T.Y., Chen, J.T., Chang, W.C., 2002. Multiple shoot formation and plant regeneration from stem nodal explants of Paphiopedilum orchids. In Vitro Cell Dev.-Plant 38, 595–597.
Chen, T.Y., Chen, J.T., Chang, W.C., 2004a. Plant regeneration through direct shoot bud formation from leaf culture of Paphiopedilum orchids. Plant Cell Tissue Organ. Cult. 76, 11–15.
Chen, Z.L., Ye, X.L., Liang, C.Y., Duan, J., 2004b. Seed germination in vitro of Paphiopedilum armeniacum and P. micranthum. Acta Hortic. 31, 540–542. Clarke, J., Gillings, M., Altavilla, N., Beattie, A., 2001. Potential problems with fluorescein diacetate assays of cell viability when testing natural products for
antimicrobial activity. J. Microbiol. Meth. 46, 261–267.
CITES, 2013. Convention on International Trade in Endangered Species of Wild Fauna and Flora, Appendices I. Geneva, Switzerland.
Copeland, L., McDonald, M., 2001. Principles of Seed Science and Technology, fourth ed. Kulwer Academic Publishers Group, MA, USA.
Ding, C.C., Wu, H., Liu, F.Y., 2004. Factors affecting the germination of Paphiopedilum armeniacum. Acta Bot. Yunnanica 26, 673–677.
Fay, M.F., 1992. Conservation of rare and endangered plants using in vitro methods. In Vitro Cell Dev.-Plant 28, 1–4.
Flamee, M., 1978. Influence of selected media and supplements on the germination and growth. Am. Orchid Soc. Bull. 47, 419–423.
Hong, P.I., Chen, J.T., Chang, W.C., 2008. Plant regeneration via protocorm like body formation and shoot multiplication from seed derived callus of a maudiae type slipper orchid. Acta Physiol. Plant. 30, 755–759.
Hsu, R.C.C., Lee, Y.I., 2012. Seed development of Cypripedium debile Rchb. f. in relation to asymbiotic germination. Hortic. Sci. 47, 1495–1498.
Huang, L.C., Lin, C.J., Kuo, C.I., Huang, B.L., Murashige, T., 2001. Paphiopedilum cloning in vitro. Sci. Hortic. 91, 111–121.
Kauth, P., Dutra, D., Johnson, T., 2008. Techniques and applications of in vitro orchid seed germination. In: Teixeira da Silva, J.A. (Ed.), Floriculture,
Ornamental and Plant Biotechnology: Advances and Topical Issues. Global Science Books, Iselworth, UK, pp. 375–391.
Knudson, L., 1922. Non-symbiotic germination of orchid seeds. Bot. Gaz. 73, 1–25.
Lee, Y.I., 2007. The asymbiotic Seed germination of six Paphiopedilum species in relation to the time of seed collection and seed pretreatment. Int. Soc.
Hortic. Sci. 381–386.
Liao, Y.Z., Chen, J.J., 2006. Asymbiotic seed germination of Paphiopedilum. In: Paphiopedilumin Taiwan IV, vol. 23. Taiwan Paphiopedilum Society, pp. 11–14.
Liu, Z.J., Chen, S.C., Chen, L.J., Lei, S.P., 2009. The Genus Paphiopedilum in China. Science Press, Beijing.
Long, B., Niemiera, A.X., Cheng, Z.Y., Long, C.L., 2010. In vitro propagation of four threatened Paphiopedilum species (Orchidaceae). Plant Cell Tissue Organ.Cult. 101, 151–162.
Ma, Y., Chen, G., Grumbine, R.E., Dao, Z., Sun, W., Guo, H., 2013. Conserving plant species with extremely small populations (PSESP) in China. Biodivers.
Conserv. 22, 803–890.
Melbourne, B., Hastings, A., 2008. Extinction risk depends strongly on factors contributing to stochasticity. Nature 454, 100–1003.
Mohanty, P., Paul, S., Das, M.C., Kumaria, S., Tandon, P., 2012. A simple and efficient protocol for the mass propagation of Cymbidium mastersii: an ornamental orchid of Northeast India. AoB Plant. 2012, 1–8. http://dx.doi.org/10.1093/aobpla/pls023.
Murashige, T., Skoog, F., 1962. A revised medium for rapid growth and bio-assays with tobacco tissue cultures. Physiol. Plant. 15, 473–497.
Nhut, D., Trang, P., Vu, N., Thuy, D., Khiem, D., Binh, N., Van, K., 2005. A wounding method and liquid culture in Paphiopedlium delenatii propagation. Propag.Ornam. Plants 5, 156–161.
Pierik, R., Sprenkels, P., Van der Harst, B., Van der Meys, Q., 1988. Seed germination and further development of plantlets of Paphiopedilum ciliolare Pfitz.
In vitro. Sci. Hortic. 34, 139–153.
Purvis, A., Gittleman, J., Cowlishaw, G., Mace, G., 2000. Predicting extinction risk in declining species. Proc. R. Soc. Lond. Ser. B Biol. 267, 1947–1952.
R Development Core Team, 2011. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Ed version 3.1.1, Vol. 2013. R Development Core Team, Vienna, Austria.
Ramsay, M., Stewart, J., 1998. Re-establishment of the lady’s slipper orchid (Cypripedium calceolus L.) in Britain. Bot. J. Linn. Soc. 126, 173–181.
Ren, H., Zhang, Q., Lu, H., Liu, H., Guo, Q., Wang, J., Jian, S., Bao, H., 2012. Wild plant species with extremely small populations require conservation and reintroduction in China. Ambio 41, 913–917.
Sarasan, V., Cripps, R., Ramsay, M.M., Atherton, C., McMichen, M., Prendergast, G., Rowntree, J.K., 2006. Conservation in vitro of threatened plants—progress in the past decade. In Vitro Cell Dev.-Plant 42, 206–214.
Sgarbi, E., Grimaudo, M., Del Prete, C., 2009. In vitro asymbiotic germination and seedling development of Limodorum abortivum (Orchidaceae). Plant Biosyst. 143, 114–119.
Sileshi, G., 2012. A critique of current trends in the statistical analysis of seed germination and viability data. Seed Sci. Res. 22, 145–159.
State Forestry Administration of China, , 2012. The Saving and Conservation Program on Extremely Small Populations in China. State Forestry Administration of China, Beijing.
Stewart, S.L., 2008. Orchid reintroduction in the United States: a mini review. N. Am. Nativ. Orch. J. 14, 54–59.
Stimart, D., Ascher, P., 1981. In vitro germination of Paphiopedilum seed on a completely defined medium. Sci. Hortic. 14, 165–170.
Swarts, N.D., Dixon, K.W., 2009. Terrestrial orchid conservation in the age of extinction. Ann. Bot. 104, 543–556.
Ye, D., Luo, Y., 2006. Paphiopedilum spicerianum, a new record of Orchidaceae from China. Acta Phytotaxon. Sin. 44, 471–473.
Zeng, S., Wu, K.L., Teixeira da Silva, J., Zhang, J.X., Chen, Z.L., Xia, N.H., Duan, J., 2012. Asymbiotic seed germination, seedling development and reintroduction of Paphiopedilum wardii Sumerh., an endangered terrestrial orchid. Sci. Hortic. 138, 198–209.
Zeng, S.J., Zhang, Y., Teixeira da Silva, J.A., Wu, K.L., Zhang, J., Duan, J., 2013. Seed biology and in vitro seed germination of Cypripedium. Crit. Rev. Biotechnol.
Khải Mùi
SBC Scientific