Hai phương pháp đã được sử dụng để sản xuất củ bi từ hai giống khoai yam khác nhau (giống Krengle và giống Kponan) bằng kỹ thuật nuôi cấy in vitro. Phương pháp 1: Trước tiên, các củ siêu bi (microtuber) của khoai yam được gây khởi phát trong in vitro và sau đó được chuyển vào đất để phát triển thành cây, những cây này sẽ sản xuất các củ khoai bi.
Cảm ứng in vitro củ khoai yam bi (minituber)
(phức hợp loài Dioscorea cayenensis - D. rotundata)
Kouadio A. Olivier • Koffi N. Konan •
Felicia N. Anike • Georges N. Agbo •
Hortense W. Dodo
Đã nhận: 28 tháng 11 năm 2010 / Chấp nhận đăng: 30 tháng 10 năm 2011 / Đăng online: 20 tháng 11 năm 2011
© Springer Science+Business Media B.V. 2011
Tóm tắt:
Hai phương pháp đã được sử dụng để sản xuất củ bi từ hai giống khoai yam khác nhau (giống Krengle và giống Kponan) bằng kỹ thuật nuôi cấy in vitro. Phương pháp 1: Trước tiên, các củ siêu bi (microtuber) của khoai yam được gây khởi phát trong in vitro và sau đó được chuyển vào đất để phát triển thành cây, những cây này sẽ sản xuất các củ khoai bi. Các cây khoai yam được thu nhận bằng cả hai cách, hoặc trồng trực tiếp những củ siêu bi vào đất hoặc cảm ứng sự nảy mầm của các củ siêu bi bằng cách xử lý với các tác nhân hóa – lý khác nhau trước khi chuyển chúng vào đất. Phương pháp 2: Đầu tiên, các cây khoai yam con được sản xuất in vitro và sau đó chuyển vào đất để phát triển thêm và tạo củ. Trong cả hai phương pháp, sự hiện diện của jasmonic acid (JA) trong môi trường nuôi cấy đã được chứng minh là cần thiết cho quá trình tạo củ, cũng như cho quá trình nảy mầm của các củ siêu bi. Việc tạo củ khoai yam bi bằng phương pháp in vitro phụ thuộc vào đa dạng các yếu tố. So với giống Krengle, giống Kponan đáp ứng tốt hơn trong quá trình tạo củ siêu bi, và 2.5 µM JA là nồng độ tối ưu cho kết quả đến 70% mẫu tạo củ siêu bi trong môi trường MS và 90% trong môi trường Tạo Củ (T-medium). Quá trình nảy mầm của các củ siêu bi cần được xử lý với JA ở nồng độ từ 1.0 đến 2.5 µM. Tổng thời gian của quá trình sản xuất củ khoai yam bi từ củ siêu bi mất 32 tuần. Ngược lại, khi trồng trực tiếp cây khoai yam con vào đất, củ khoai yam bi sẽ được thu hoạch trong vòng 20 tuần. Trong phương pháp này, đầu tiên cây con được trồng 8 tuần trên môi trường có chứa JA (0.1-1.0 µM) và 8% sucrose để khởi phát sự tăng trưởng và ra rễ cho cây.
Từ khóa: Jasmonic acid - Yam - D. rotundata - Củ bi (Minituber) - Củ siêu bi (Microtuber) - Trạng thái ngủ (Dormancy)
Giới thiệu
Cây khoai yam thuộc họ Dioscoreacea và chi Dioscorea. Chúng là nguồn thực phẩm chủ yếu ở nhiều nước nhiệt đới (Hahn 1995). Tây Phi là vùng sản xuất khoai yam chính, với hơn 4.4 triệu ha được thu hoạch trong năm 2008 (FAOstat 2010). Khoai yam có vai trò quan trọng vì giá trị dinh dưỡng tuyệt vời của chúng. Ví dụ, 100g khoai yam ăn được cung cấp 16.4 - 31.8g carbohydrate, 1.4 – 3.5g protein và 0.2 – 0.4g chất béo (Osagie và Opoku 1992). Khoai yam cũng chứa 65-81% nước, vitamin và khoáng chất. Tuy nhiên, sản lượng khoai yam bị hạn chế bởi các yếu tố phi sinh học, sâu bệnh (Emehute và cộng sự. 1998), sự khan hiếm vật liệu trồng (Onovo và cộng sự. 2007) và hao hụt khi lưu trữ (Craufurd và cộng sự. 2001). Sự khan hiếm nguyên liệu trồng trọt là một phần lý lẽ nhằm biện minh cho chi phí sản xuất khoai yam cao so với các loại cây trồng thân củ và thân rễ khác.
Theo phương pháp truyền thống, khoai yam được nhân giống bằng cách sử dụng toàn bộ củ hoặc các mảnh củ tương đối lớn (Orkwor và cộng sự. 1998). Để tạo ra vật liệu trồng, khoảng 40% sản lượng thu hoạch được giữ lại. Điều này làm giảm trữ lượng thực phẩm có sẵn và do đó, tạo ra một mối đe dọa đáng kể về an ninh lương thực, đặc biệt là ở các nước đang phát triển. Hơn nữa, việc sử dụng củ yam làm vật liệu trồng góp phần lan truyền mầm bệnh trong trang trại, và làm tăng sự hao hụt khoai yam (IITA và NRI 2006). Kỹ thuật nuôi cấy mô phân sinh đã được sử dụng thành công để sản xuất cây khoai yam sạch bệnh với năng suất cao (Balogun 2009). Thể như protocorn và thân rễ đã được sử dụng thành công trong nhân giống in vitro của nhiều loài thực vật để vượt qua những khó khăn nhất định còn tồn tại trong phương pháp nhân giống thông thường (Ng và Saleh 2011; Huang và Chung 2011; Rayirath và cộng sự. 2011; Torres-Mora´n và cộng sự. 2010). Tương tự, một phương pháp nhân giống khoai yam bằng cách sử dụng củ siêu bi sạch bệnh có nguồn gốc in vitro đã được đề xuất (Ammirato 1984). Tuy nhiên, giai đoạn ngủ nghỉ kéo dài và thiếu sự nảy mầm đồng đều là những hạn chế chính trong việc sử dụng củ siêu bi để nhân giống khoai yam (Asiedu và cộng sự. 1998; Donnelly và cộng sự. 2003).
Nghiên cứu này tìm cách sản xuất củ bi mà có thể sử dụng để nhân giống khoai yam. Củ bi lớn hơn (khoảng 30 lần) so với củ siêu bi. Chúng được sản xuất trong đất trong điều kiện môi trường nhà kính từ cây con in vitro, trong khi củ siêu bi được sản xuất trong các ống nghiệm bằng môi trường tổng hợp. Ảnh hưởng của Jasmonic acid (JA) đến quá trình hình thành củ yam đã được xem xét trong nghiên cứu này. JA có nguồn gốc từ acid béo linoleic, và được sản xuất trong tự nhiên từ thực vật. Chúng tham gia vào các hoạt động chuyển hóa thực vật khác nhau dẫn đến sự ức chế tăng trưởng, lão hóa, rụng lá, hình thành củ, phá bỏ trạng thái ngủ của củ trong cây
D. alata (Bazabakana và cộng sự. 1999), cũng như cảm ứng sản xuất các chất chuyển hóa thứ cấp như hypericinshyperforin và rosmarinic acid (Costa và cộng sự. 2011; Krzyzanowska và cộng sự. 2011).
Hai giống khoai yam Kponan và Krengle, thuộc họ D. cayenensis-rotundata, được chọn trong nghiên cứu này vì chúng được tiêu thụ rộng rãi nhất trên toàn thế giới. Giống Kponan có vỏ củ mịn và phần thịt củ trắng, trong khi giống Krengle vỏ củ có gai và thịt củ màu vàng.
Vật liệu và phương pháp
Vật liệu thực vật
Cây con in vitro của hai giống khoai yam
D. cayenensis - rotundata (giống Krengle và Kponan) được cung cấp bởi Trung tâm Nghiên cứu Nông nghiệp Quốc gia Bờ Biển Ngà (CNRA - www.cnra.ci). Các cây khoai yam con được nhân giống trong môi trường MS (Murashige và Skoog 1962) và cấy chuyền mỗi 4 tuần vào môi trường mới.
Cảm ứng củ siêu bi khoai yam
Các đoạn mắt đơn được cắt từ cây khoai yam con 8 tuần tuổi và cấy vào cả môi trường tạo củ (T-medium; Mantell và Hugo 1989) và môi trường MS dạng thạch với 3g/L phytagel. Môi trường tạo củ được biến đổi từ môi trường MS với lượng nitrogen ít hơn 6%. Môi trường nuôi cấy được bổ sung với các vitamin MS (cho môi trường MS) hoặc thiamine (1mg/ml cho môi trường tạo củ), myoinositol (100mg/L) và sucrose (2, 4, 8 và 16%, w/v). pH môi trường được chỉnh đến 5.8 trước khi hấp khử trùng tại áp suất 1.04kg/cm2, 121oC trong 30 phút. JA được lọc vô trùng và thêm vào môi trường tại nồng độ 0.5, 1.5, 2.5, 3.5 và 4.5 µM.
Các mẫu nuôi cấy được ủ trong tủ tăng trưởng thực vật Percival (model CU36, Percival Scientific, Inc., Perry, IA) với chu kỳ quang 16 giờ sáng/ 8 giờ tối, tại 25±3°C, và độ ẩm 60–70%. Cho mỗi nghiệm thức, 30 mẫu mắt đơn được sử dụng và một mẫu được cấy trong một ống nghiệm. Số ngày củ siêu bi xuất hiện, số lượng cây con tạo củ siêu vi (phần trăm cây tạo củ), số lượng củ siêu bi trên mỗi cây, và trọng lượng tươi của củ sẽ được ghi nhận.
Gây nảy mầm củ khoai yam siêu bi
Củ siêu bi được thu hoạch từ cây con in vitro 8 tuần tuổi. Củ siêu bi được rửa với nước vô trùng, thấm khô với giấy lọc vô trùng và đặt trong đĩa petri 35mm kín đã vô trùng, sau đó giữ đĩa petri trong tủ cấy khoảng 24h. Củ siêu bi được xử lý với nhiều loại tác nhân vật lý và hormon để cảm ứng việc nảy mầm.
Các nghiệm thức với tác nhân vật lý
Các củ khoai siêu bi được chuyển sang đĩa petri 35mm (1 củ/đĩa) được dán kín bằng parafilm và giữ ở nhiệt độ phòng trong tối liên tục hay sáng liên tục hoặc trong buồng tăng trưởng Percival (model CU36, Percival Scientific, Inc., Perry, IA) với chu kỳ quang 16 giờ sáng/ 8 giờ tối, tại 25±3°C. Một số củ siêu bi được quấn bằng bông không thấm đã được làm ướt trước khi chuyển sang đĩa petri để tạo ra môi trường ẩm quanh chúng. Một số đĩa được giữ mở để kiểm tra ảnh hưởng của việc thông khí. Tỷ lệ nảy mầm được ghi nhận.
Các nghiệm thức xử lý với JA
JA được sử dụng để gây cảm ứng nảy mầm củ siêu bi. Các củ siêu bi được chuyển vào ống nghiệm (1củ/ống) có chứa môi trường MS rắn +2% sucrose (w/v), và được bổ sung JA ở nồng độ 0.5, 1.5, 2.5, 3.5, 4.5 và 5.5 µM. Mười lăm củ siêu bi được sử dụng cho mỗi nghiễm thức nồng độ JA. Các củ này sẽ được giữ trên môi trường cho đến khi nảy mầm. Tỷ lệ nảy mầm được ghi nhận.
Xác định hàm lượng carbohydrate trong củ yam siêu bi
Trong quá trình nảy mầm, mỗi 4 tuần, các củ siêu bi sẽ được lấy ngẫu nhiên từ mỗi môi trường chứa JA để định lượng hàm lượng đường tổng và tinh bột. Củ siêu bi được sấy khô ở 130°C, 1 giờ trong tủ sấy phòng thí nghiệm (Fisher Thermo Scientific Inc, Pittsburgh, PA), và nghiền thành bột trong cối. Để chiết đường tan, 2g bột khoai yam được trộn với 5ml ethanol 80% đã đun sôi. Dịch chiết được ly tâm ở 2500 vòng/phút trong 5 phút. Mỗi mẫu được chiết ba lần, và các chất dịch nổi được thu chung lại để phân tích đường.
Đường tổng được phân tích bằng phương pháp Buysse và Merckx (1993) đã tối ưu hóa. Dung dịch chuẩn (200ul) hoặc dung dịch mẫu (200ul) được phân phối vào ống nghiệm. 200ul dung dịch phenol 5% (v/v) được thêm vào ống nghiệm và 1ml H2SO4 đậm đặc (98%) được thêm vào để tạo ra dung dịch cuối. Dung dịch cuối được đồng hóa và đun nóng trong bể cách thủy ở 100°C trong 5 phút. Sau đó được làm nguội khoảng 30 phút trong tối để tránh bị oxy hóa. Đường tổng được đo bằng máy quang phổ ở bước sóng 480nm.
Phần cặn thu hồi từ quá trình ly tâm ethanol được rửa hai lần với 5ml dung dịch perchloric acid 30% (v/v). Các phần dịch nổi perchloric được sử dụng để phân tích tinh bột (Horwitz 1975).
Sản xuất củ bi từ củ siêu bi
Củ siêu bi đã nảy mầm được chuyển vào đất khi mầm cây dài ít nhất 2cm. Đất trồng được tạo thành từ hỗn hợp Pro-Mix (Premier Horticulture LTEE / LTD, Quebec, Canada) và cát động lực (play sand) với tỷ lệ 3:1 trong thùng nhựa 6.5 inch (Belden Plastics, St. Paul MN, USA). Cây yam con được giữ trong tủ tăng trưởng thực vật Enconair (model A60, Enconair, Winnipeg, MB, Canada) được cài đặt với 16 giờ sáng ở 28°C, và 8 giờ tối ở 24°C và 85% thông khí. Chúng được tưới nước hai lần một tuần trong 2 tuần đầu, sau đó một lần một tuần cho đến khi cây trưởng thành. Sau 12 tuần chuyển sang đất, tiến hành thu hoạch. Kích thước và số lượng củ bi của mỗi cây được ghi nhận.
Sản xuất củ bi từ cây con in vitro
Các đoạn mắt đơn từ cây yam con được nuôi cấy trên môi trường MS chứa sucrose (2, 4, 8%; w/v) và JA (0.1, 1.0, 2.5, 5.0, 10.0 µM). Sau 8 tuần nuôi cấy trong tử tăng trưởng thực vật Percival đã được cài đặt ở chu kì quang 16 giờ sáng/8 giờ tối, 25±3°C, chiều dài các chồi và rễ được đo lường. Để tạo củ bi, đầu tiên cây yam con được tiến hành thích nghi khí hậu trong 3 ngày bằng cách bằng cách loại bỏ nắp các ống nghiệm chứa cây con và thêm 5–10 ml nước vô trùng lên bề mặt môi trường thạch. Cây con đã được chuyển vào đất trong tủ tăng trưởng thực vật Enconair (model A60, Enconair, Winnipeg, MB, Canada) được cài đặt với 16 giờ sáng ở 28°C, và 8 giờ tối ở 24°C và 85% thông khí. Ba mươi (30) cây con được sử dụng cho mỗi nghiệm thức xử lý với JA, và mỗi nghiệm thức được lặp lại ba lần. Cây con được tưới nước hai lần một tuần trong 2 tuần đầu và sau đó làn mỗi lần một tuần. Củ bi được thu hoạch sau 12 tuần. Trọng lượng, kích thước và số lượng củ bi của mỗi cây được ghi nhận.
Phân tích thống kê
Mỗi nghiệm thức được lặp lại 3 lần và dữ liệu được phân tích bằng cách sử dụng phương pháp phân tích phương sai (ANOVA) với SAS (Schlotzhauer và Littell 1997). Các biến thiên giữa các giá trị trung bình được so sánh bằng kiểm định Tukey tại P<0.05 (Westfall và cộng sự. 1999).
Kết quả
Các mẫu mắt được cấy vào môi trường đã phát triển thành cây trưởng thành và tạo được củ siêu bi trong vòng 8 tuần. Khi các củ siêu bi trưởng thành, chúng được thu hoạch, sấy khô và trải qua các xử lý để nảy mầm. Một vài thông số đã được nghiên cứu để tối ưu hóa quá trình tạo củ siêu bi của cây khoai yam.
Ảnh hưởng của nồng độ sucrose
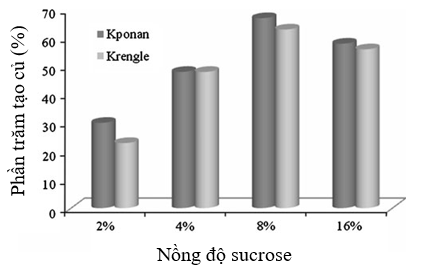
Sucrose được sử dụng kết hợp trong môi trường tạo củ ở nồng độ 2, 4, 8 và 16% (w/v). Dữ liệu được trình bày trong Hình 1 cho thấy rằng hai giống khoai yam thử nghiệm (Kponan và Krengle) có đáp ứng tương tự trong các nghiệm thức xử lý với sucrose. Số lượng củ cao nhất thu được với 8% sucrose (67% đối với giống Kponan và 63% với giống Krengle). Có sự khác biệt đáng kể giữa số lượng củ hình thành ở nghiệm thức 8% và 16% sucrose (P< 0.05). Với 16% sucrose, tỷ lệ phần trăm tạo củ giảm xuống còn 61% và 59% lần lượt đối với giống Kponan và Krengle. Các quan sát tương tự cũng đã được thực hiện bởi nhiều nhà nghiên cứu trên một số loài Dioscorea khác (KhuriS 1995; Alizadeh và cộng sự. 1998).
Hình 1: Ảnh hưởng của nồng độ sucrose đến sự hình thành củ in vitro của hai giống khoai yam Kponan và Krengle, được nuôi cấy trên môi trường MS
Ảnh hưởng của môi trường nuôi cấy và nồng độ JA
Môi trường MS và môi trường tạo củ được dùng để so sánh khả năng sản xuất củ siêu bi khoai yam. Hiệu quả tạo củ (Bảng 1) được đánh giá sau 12 tuần. Hai giống khoai yam đáp ứng khác nhau với môi trường nuôi cấy. Đối với giống Kponan, tỷ lệ tạo củ là 60% thu được trong hai môi trường đối chứng (môi trường MS hoặc môi trường tạo củ không bổ sung JA), trong khi với giống Krengle, 60% và 10% tạo củ đã được ghi nhận lần lượt cho cho môi trường MS và môi tường tạo củ. Việc thêm JA vào môi trường nuôi cấy đã làm tăng đáng kể tấn số tạo củ của hai giống khoai yam. Các nồng độ tối ưu là 2.5 µM với giống Kponan và 0.5µM đối với giống Krengle. Môi trường tạo củ thích hợp nhất cho giống Kponan trong khi môi trường MS thuận lợi cho giống Krengle (Bảng 1). Như vậy, 90% cây con Kponan tạo củ siêu bi trong môi trường tạo củ có 2.5µM JA, trong khi 90% cây con Krengle sản xuất củ siêu bi trong môi trường MS có 0.5 µM JA (Bảng 1).
|
Bảng 1: Ảnh hưởng của JA đến sự tạo củ in vitro của hai giống khoai yam Kponan và Krengle. 8% sucrose được thêm vào môi trường nuôi cấy |
|
|
|
Nồng độ JA (µM) |
|
|
0 (Đối chứng) |
0.5 |
1.5 |
2.5 |
3.5 |
4.5 |
|
Giống kponan |
|
|
|
|
|
|
Môi tường tạo củ (T –medium)
% tạo củ |
60.0c |
83.33b |
86.67b |
90.0a |
60.0c |
30.0d |
|
Số ngày |
30–60 |
20–30 |
20–30 |
15–20 |
30–60 |
30–60 |
|
Số củ/cây con |
1 |
1 |
1 |
1 |
1 |
1 |
|
Trọng lượng tươi củ siêu bi (mg) |
144.5e |
230.5d |
314.9b |
367.1a |
248.1c |
251c |
|
Môi tường MS |
|
|
|
|
|
|
|
% tạo củ |
60.0c |
66.67b |
66.67b |
70.0a |
40.0d |
20.0e |
|
Số ngày |
30–60 |
20–30 |
20–30 |
20–30 |
30–60 |
30–60 |
|
Số củ/cây con |
1 |
1 |
1 |
1 |
1 |
1 |
|
Trọng lượng tươi củ siêu bi (mg) |
159.3b |
162.7b |
210.6a |
215.3a |
215.6a |
212.8a |
Giống krengle
Môi tường tạo củ (T –medium) |
|
|
|
|
|
|
|
% tạo củ |
10.0c |
53.3a |
33.33b |
6.66c |
nt |
nt |
|
Số ngày |
30–60 |
30–60 |
30–60 |
30–60 |
nt |
nt |
|
Số củ/cây con |
1 |
1–2 |
1 |
1 |
nt |
nt |
|
Trọng lượng tươi củ siêu bi (mg) |
183.2a |
190a |
187.3a |
189a |
nt |
nt |
|
Môi tường MS |
|
|
|
|
|
|
|
% tạo củ |
60.0c |
90.0a |
83.33b |
33.3d |
6.66e |
nt |
|
Số ngày |
30–60 |
30–60 |
30–60 |
30–60 |
30–60 |
nt |
|
Số củ/cây con |
1 |
1–2 |
1 |
1 |
1 |
nt |
|
Trọng lượng tươi củ siêu bi (mg) |
259.3c |
407a |
322.7b |
251.9c |
255.6c |
nt |
Giá trị trung bình trong cùng 1 hàng với các chữ cái khác nhau biểu thị sự khác biệt thống kê (P<0.05) giữa các nghiệm thức cho mỗi giống khoai yam.
N=30 cây con cho mỗi nghiệm thức; nt: không kiểm tra (not test) |
Thời gian tạo củ của giống Kponan đã rút ngắn khi bổ sung JA, đặc biệt khi các cây con được nuôi cấy trong môi trường tạo củ. Trong môi trường có chứa 0.5 hoặc 1.5µM JA, củ siêu bi được hình thành sau 20-30 ngày so với 30-60 ngày trong môi trường không có JA. Đáng chú ý nhất ở nồng độ 2.5µM JA, sự hình thành các củ siêu bi diễn ra trong vòng 15–20 ngày, giảm một nửa thời gian để tạo củ siêu bi trong môi trường không có JA. Tuy nhiên, nồng độ JA cao hơn (3.5 và 4.5µM) làm kéo dài thời gian hình thành củ đến 30-60 ngày, và đồng thời ức chế sự tạo củ siêu bi. Với 5.5µM JA, quá trình tạo củ siêu bi hoàn toàn bị ức chế đối với cả hai giống khoai yam. Cây yam con bị còi cọc, vàng và không tạo rễ (dữ liệu không được trình bày). Ở cả hai môi trường thử nghiệm, JA làm tăng đáng kể trọng lượng tươi của các củ siêu bi, gấp 1.5–2.5 lần, đặc biệt ở mức 0.5µM đối với giống Krengle và 2.5µM cho giống Kponan. Nhìn chung, mỗi cây con chỉ tạo được một củ siêu bi, nhưng ở nồng độ 0.5µM JA, một vài cây con giống Krengle tạo được 2 củ trên mỗi cây.
Gây nảy mầm củ yam siêu bi
Gây nảy mầm củ siêu bi là một bước quan trọng để hướng tới việc sản xuất củ bi khoai yam. Khi nảy mầm, các củ siêu bi được chuyển vào trồng trong đất và các cây mới được đánh giá cho việc sản xuất củ bi. Tuy nhiên, một bước quan trọng là phá bỏ trạng thái ngủ của các củ siêu bi. Trạng thái ngủ nghỉ của củ khoai yam vẫn chưa được hiểu rõ. Do đó, một số phương pháp xử lý gồm chu kỳ sáng, tối và nồng độ JA đã được thử nghiệm để phá bỏ trạng thái ngủ của củ siêu bi khoai yam thu được.
JA làm tăng sự nảy mầm của củ siêu bi
Sau khi thu hoạch, các củ siêu bi được sấy khô và đặt vào môi trường MS rắn chứa 2% sucrose, và được bổ sung với nhiều nồng độ JA khác nhau để cảm ứng sự nảy mầm. Nhìn chung, trạng thái ngủ đã bị phá vỡ trong các điều kiện này, và củ siêu bi đã nảy mầm thành công sau khoảng 12 tuần nuôi cấy. Tuy nhiên, kích thước của củ ảnh hưởng đến sự nảy mầm. Phần lớn các củ nảy mầm được đều có trọng lượng tươi trên 150mg. Củ siêu bi nặng khoảng 300mg nảy mầm nhanh hơn so với những củ có trọng lượng nhỏ hơn. Không có sự nảy mầm ở những củ siêu bi có trọng lượng nhỏ hơn 150 mg. Những dữ liệu này phù hợp với những báo cáo trước đây của Onovo và cộng sự (2010a, b) khi chỉ ra rằng củ siêu bi có chiều dài khoảng 1.5 – 2 cm nảy mầm kém hơn những củ có chiều dài khoảng 3.5cm hoặc hơn. Họ cho rằng những củ siêu bi lớn có nhiều chất dinh dưỡng dự trữ hơn và do đó, có thể nảy mầm dễ dàng hơn.
Trong nghiên cứu này, JA làm tăng đáng kể tỷ lệ nảy mầm của củ siêu bi khoai yam (Hình 2). Trong khi không có sự nảy mầm ở các củ đối chứng, các củ siêu bi đã được xử lý với JA dễ nảy mầm, và tỷ lệ nảy mầm cao nhất là 55% thu được ở nồng độ 2.5µM JA. Tuy nhiên, nồng độ cao hơn của JA hoàn toàn ức chế sự nảy mầm của củ siêu bi.
Nuôi cấy trong điều kiện tối liên tục thúc đẩy sự nảy mầm của củ khoai yam siêu bi
Để kiểm tra tác động của chu kỳ quang đến sự nảy mầm, các củ siêu bi từ giống Krengle được chọn để xử lý với chu kỳ sáng/tối. Sự nảy mầm xảy ra trong khoảng 20 tuần, chủ yếu là những củ được nuôi cấy trong tối liên tục. Trong điều kiện này tỷ lệ nảy mầm cao nhất là 40%, thu được khi các củ siêu bi được đặt trong các đĩa petri kín (Bảng 2). Nuôi cấy dưới ánh sáng liên tục hoặc 16 giờ sáng / 8 giờ tối, kết hợp với việc sử dụng đĩa petri mở hoặc đóng và có hoặc không có vải cotton ẩm đều không có hiệu quả trong việc kích hoạt sự nảy mầm của củ siêu bi. Điều này ngược với các quan sát của Onovo và cộng sự. (2010a, b) khi báo cáo rằng 100% củ siêu bi nảy mầm dưới điều kiện ánh sáng, và rút ngắn thời gian nảy mầm với các chu kỳ quang dài hơn.
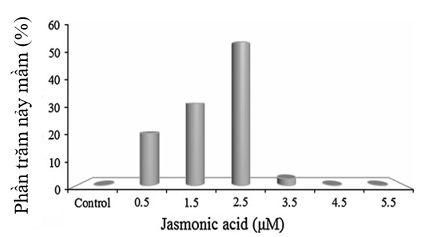
Hình 2: Ảnh hưởng của nồng độ JA đến sự nảy mầm của củ siêu bi giống Krengle được nuôi cấy trên môi trường MS
|
Bảng 2: Ảnh hưởng của việc xử lý sáng và tối đối với quá trình nảy mầm của củ khoai yam siêu bi giống Krengle |
|
Các nghiệm thức chiếu sáng |
Phần trăm nảy mầm |
|
Sáng liên tục |
|
|
Đĩa mở |
0c |
|
Đĩa kín |
10a |
|
Đĩa kín và ầm |
2b |
|
16 giờ sáng /8 giờ tối |
|
|
Đĩa mở |
0b |
|
Đĩa kín |
20a |
|
Đĩa kín và ầm |
0b |
|
Tối liên tục |
|
|
Đĩa mở |
0c |
|
Đĩa kín |
40a |
|
Đĩa kín và ầm |
5b |
Trong mỗi nghiệm thức, giá trị trung bình với các chữ cái khác nhau có sự khác biệt đáng kể với mức xác suất 0.05.
N=15 củ siêu bi mỗi nghiệm thức |
Sự thay đổi của hàm lượng carbohydrate trong suốt quá trình nảy mầm của củ siêu bi khoai yam
Khi củ ở trạng thái ngủ thường giảm các hoạt động chuyển hóa nội sinh, dẫn đến mất rất ít chất dinh dưỡng dự trữ. Delaplace và cộng sự. (2008) đã sử dụng những thay đổi trong hàm lượng carbohydrate (đường tổng và tinh bột) để theo dõi các hoạt động chuyển hóa trong cây khoai tây trồng trên cánh đồng. Trong nghiên cứu này, các thí nghiệm tương tự đã được thực hiện để định lượng carbohydrate trong củ yam trong suốt quá trình nảy mầm trên môi trường MS có bổ sung JA với nồng độ 2.5µM. Vào lúc thu hoạch, hàm lượng đường tổng và hàm lượng tinh bột trong củ siêu bi của giống Krengle lần lượt là 3.23% và 73.6%. Sau 8 tuần trên môi trường nảy mầm, không có sự thay đổi đáng kể nào diễn ra. Tuy nhiên, những thay đổi đã trở nên đáng kể (P<0.05) có thể nhận thấy trong suốt 12 tuần nuôi cấy khi các củ siêu bi bắt đầu nảy mầm. Hàm lượng đường tổng tăng từ 3.23 đến 4.15%, và mức độ tinh bột giảm từ 73.6 xuống 72.78% (Bảng 3). Khi tiếp tục nuôi cấy, lượng đường tăng đáng kể lên 5.56%, trong khi lượng tinh bột tổng giảm xuống còn 70.25%.
|
Bảng 3: Hàm lượng đường và tinh bột trong củ siêu bi của giống Krengle trong suốt quá trình nảy mầm trên môi trường MS chứa 2% sucrose + 2.5 µM JA |
|
|
Initial |
4 weeks |
8 weeks |
12 weeks |
16 weeks |
20 weeks |
|
Đường tổng (%) |
3.23c |
3.36c |
3.58c |
4.15b |
5.37a |
5.56a |
|
Tinh bột (%) |
73.6c |
74.4c |
74.05c |
72.78b |
70.25a |
70.95a |
|
Giá trị trung bình trong cùng hàng với cùng chữ cái không có sự khác biệt đáng kể với mức xác suất 0.05 |
Sản xuất cây yam từ củ siêu bi để thu hoạch củ khoai yam bi
Sau khi nảy mầm trên môi trường MS, các củ yam siêu bi được chuyển vào đất, chồi cây được kéo dài thành công (Hình 3a, b, c) và cuối cùng là các cây khỏe mạnh bình thường (Hình 3) được tạo ra. Củ bi (Hình 3e) được thu hoạch sau khoảng 12 tuần từ các cây yam đã phát triển từ củ siêu bi. Nhìn chung, có từ một đến hai củ yam bi có trọng lượng tươi khoảng 1.5–3.5g và dài 1.5-2.5cm đã được thu hoạch từ mỗi cây. Tuy nhiên, khi các củ siêu bi được trồng trực tiếp vào đất sau khi thu hoạch, chỉ khoảng 10% phát triển thành cây đầy đủ, và phần còn lại (>90%) bị phân hủy trong đất. Do đó, việc làm nảy mầm củ siêu bi trước khi chuyển vào đất là một bước quan trọng và cần thiết. Các điều kiện nảy mầm không ảnh hưởng đến việc sản xuất củ bi. Tóm lại, quy trình sản xuất củ yam bi yam từ các củ siêu bi cần hơn 32 tuần, trong đó mất 8 tuần để hình thành củ siêu bi, ít nhất 12 tuần để củ siêu bi nảy mầm và 12 tuần để cây khoai yam phát triển và thu hoạch củ bi.

Hình 3: Sản xuất củ khoai yam bi từ củ siêu bi giống Krengle – A: một củ siêu bi nảy mầm. B&C: Kéo dài chồi tại 1 WATS (B) và 2 WATS (C). D: cây 8 tuần tuổi từ 1 củ siêu bi giống Krengle tăng trưởng trong từ tăng trưởng thực vật. E: củ khoai yam bi tươi giống Krengle được thu hoạch từ cây sau 12 tuần trồng trong đất. WATS: số tuần sau khi chuyển vào đất.
Sản xuất củ khoai yam bi bằng cách trồng trực tiếp cây con in vitro vào đất
Tăng trưởng chồi cây
Sử dụng củ siêu bi để sản xuất củ khoai yam bi là một quá trình kéo dài (> 32 tuần), chậm và tẻ nhạt vì số lượng củ siêu bi nảy mầm bị hạn chế. Một phương pháp thay thế là trồng trực tiếp các cây yam con in vitro vào đất. Để chuẩn bị cây con, một vài thông số đã được nghiên cứu để cho phép chúng thích nghi sự thay đổi từ giai đoạn in vitro vào đất để hạn chế sự stress. Sử dụng kết hợp JA và sucrose đã được chứng minh giúp thúc đẩy sự phát triển bộ rễ khỏe cho phép thực vật chịu đựng những thay đổi trong điều kiện môi trường khi chuyển từ in vitro vào đất (Ravnikar và Gogala 1990). Cây yam con được khởi phát bằng cách nuôi cấy các mẫu mắt trên môi trường MS bổ sung với các nồng độ khác nhau của sucrose và JA. Sau 6 tuần, cây được lấy ra từ ống nghiệm và chuyển vào đất. Bảng 4 cho thấy sự tăng trưởng của chồi cây và sự phát triển của rễ được thúc đẩy tốt nhất trên môi trường có bổ sung sucrose tại 4% và 8% đối với cả hai giống khoai yam Kponan và Krengle. Chiều cao chồi cây là 3-5 cm và tăng tỷ lệ thuận với nồng độ JA trong môi trường, đặc biệt là ở 0.1 và 1.0 µM (Hình 4). Trong khi 5 µM JA gây ức chế sự tăng trưởng của cây giống Krengle, giống Kponan bị ức chế tăng trưởng khi quan sát tại nồng độ 10 µM JA (Bảng 4).

Hình 4: Ảnh hưởng của nồng độ JA và sucrose đến sự phát triển của chồi cây và rễ trong cây yam con được nuôi cấy trên môi trường MS. Các cây yam con từ giống Kponan hình thành từ những mẫu mắt đơn sau 4 tuần nuôi cấy trên môi trường MS có bổ sung nồng độ JA khác nhau.
|
Bảng 4: Ảnh hưởng của nồng độ sucrose và JA đến việc tạo cây yam con in vitro trên môi trường MS |
|
|
Jasmonic acid (µM) |
|
|
0 (Đối chứng) |
0.1 |
1.0 |
2.5 |
5.0 |
10.0 |
|
Giống Kponan |
|
|
|
|
|
|
Chồi cây tăng trưởng (cm)
2% sucrose |
2.5c |
3.8b |
4.1a |
2.7c |
nt |
nt |
|
4% sucrose |
3.8b |
5.4a |
5.9a |
5.0a |
3.1b |
2.1c |
|
8% sucrose |
3.1c |
4.7b |
5.6a |
4.1b |
2.0d |
nt |
|
Rễ phát triển (cm) |
|
|
|
|
|
|
|
2% sucrose |
3.1c |
6.7a |
6.1a |
4.0b |
nt |
nt |
|
4% sucrose |
5.3c |
8.2a |
7.1b |
5.7c |
3.1d |
1.7e |
|
8% sucrose |
8.0c |
12.0a |
10.2b |
5.7d |
4.3e |
nt |
Giống Krengle
Chồi cây tăng trưởng (cm) |
|
|
|
|
|
|
|
2% sucrose |
3.5c |
4.4b |
5.0a |
3.9c |
3.5c |
2.6d |
|
4% sucrose |
4.7c |
6.1a |
6.5a |
5.5b |
4.3c |
3.3d |
|
8% sucrose |
4.1b |
5.3a |
5.6a |
4.8a |
nt |
nt |
|
Rễ phát triển (cm) |
|
|
|
|
|
|
|
2% sucrose |
3.1d |
8.8a |
7.0b |
4.2c |
3.9c |
3.9d |
|
4% sucrose |
5.3c |
10.0a |
8.2b |
5.5c |
3.1d |
1.5e |
|
8% sucrose |
8.0b |
15.8a |
14.0a |
5.1c |
nt |
nt |
Giá trị trung bình trong cùng hàng với các chữ cái khác nhau biểu hiện sự khác biệt về thống kê (P<0.05) giữa các nghiệm thức cho mỗi giống khoai yam.
N=30 cây con mỗi nghiệm thức |
Sự phát triển rễ
Sucrose ở nồng độ 8% đã thúc đẩy hệ thống rễ của hai giống khoai yam phát triển đáng kể (P<0.05). Tuy nhiên, chiều dài rễ ngắn hơn so với môi trường có chứa 4% sucrose. Ví dụ, đối với giống Kponan, khi môi trường chứa 4% sucrose và JA ở nồng độ 0.1 và 1.0 µM lần lượt tạo rễ dài 12 cm và 10.2 cm, trong khi chiều dài rễ lần lượt là 8.2 và 7.1 cm trong môi trường chứa 8% sucrose (Bảng 4). Đối với giống Krengle, môi trường chứa 0.1µM JA tạo rễ dài 10cm và 15.8 cm lần lượt với 4% và 8% sucrose. Tuy nhiên, với 8% sucrose, sự phát triển của rễ giảm khi tăng nồng độ JA, và 10 µM JA hoàn toàn ức chế sự hình thành rễ (Hình 4). Cây con đã ra rễ đã thích nghi và sống sót thành công 100% khi chuyển vào đất trong nhà kính.
Sản xuất củ khoai yam bi
Các cây yam con được chuyển vào trồng trong đất đã tạo củ bi trong vòng 14 tuần. Kích thước của các củ bi lớn hơn khoảng 4 lần so với các củ bi được sản xuất từ các cây có nguồn gốc từ củ siêu bi. Bảng 5 cho thấy giống Kponan từ các cây con trong nghiệm thức với môi trường chứa 8% sucrose đã tạo ra hơn 2 củ trên mỗi cây. Các cây con được xử lý với 0.1 và 1.0 µM JA tạo ra các củ bi lớn nhất từ 7.4–7.5 g và dài 2.5 cm (Hình 5). Tuy nhiên, trong nghiệm thức xử lý với môi trường chứa 4% sucrose thì các cây con cho củ lớn nhất (3.8 g, 2.5 cm) ở nồng độ 0.1µM JA. Đối với giống Krengle, cây con có nguồn gốc từ môi trường MS bổ sung 8%sucrose và chứa 0.1 và 1.0 µM JA tạo ra các củ khoai bi lớn nhất và dài nhất (11.5–14.2 g; 3–4 cm).
|
Bảng 5: Sản xuất củ yam bi từ cây con đã tiền xử lý in vitro trong môi trường MS chứa các nồng độ sucrose và JA khác nhau |
|
Nồng độ JA |
Kích thước củ (cm) |
Khối lượng củ (g) |
Số củ/cây con |
|
Giống. Kponan |
|
|
|
|
8% sucrose |
|
|
|
|
Đối chứng |
1.5–2.8 |
1.0–1.7 |
1 |
|
0.1 µM |
1.5–2.5 |
1.5–7.4 |
2 |
|
1.0 µM |
1.5–2.5 |
1.5–7.5 |
2 |
|
2.5 µM |
1.5–2.5 |
1.5–4.5 |
3 |
|
4% sucrose |
|
|
|
|
Đối chứng |
1.0–1.5 |
1.0–1.5 |
1 |
|
0.1 µM |
2.0–2.5 |
1.0–3.8 |
1 |
|
1.0 µM |
2.0–2.5 |
1.0–3.7 |
1 |
|
2.5 µM |
2.0–2.3 |
1.05–3.3 |
1 |
|
Giống Krengle |
|
|
|
|
8% sucrose |
|
|
|
|
Đối chứng |
2.0–2.5 |
4.0–6.7 |
1 |
|
0.1 µM |
2.0–4.1 |
5.0–14.2 |
1–2 |
|
1.0 µM |
2.2–3.0 |
5.0–11.5 |
1–2 |
|
2.5 µM |
2.0–2.4 |
2.5–3.8 |
1 |
|
4% sucrose |
|
|
|
|
Đối chứng |
2.0–3.0 |
3.0–3.3 |
1 |
|
0.1 µM |
2.0–3.0 |
2.2–6.2 |
1–2 |
|
1.0 µM |
4.5–3.5 |
2.6–4.0 |
1–2 |
|
2.5 µM |
1.5–2.0 |
1.0–4.8 |
1 |
|
N=15 cây con mỗi nghiệm thức |
Hình 5: Củ khoai yam bi được tạo thành từ cây con in vitro đã tiền xử lý với *% sucrose và 0.1µM. Củ khoai bi được thu hoạch 12 tuần sau khi cây con được chuyển vào đất. A: củ bi từ giống Kponan. B: củ bi từ giống Krengle.
Thảo luận
Sự khan hiếm vật liệu trồng là một hạn chế nghiêm trọng trong việc sản xuất khoai yam (Yan và cộng sự. 2011). Nghiên cứu này được tiến hành để phát triển phương pháp nuôi cấy mô giúp sản xuất củ khoai yam bi có thể được sử dụng làm nguyên liệu trồng và như một phương pháp thay thế giúp giảm thiểu tình trạng khan hiếm khoai yam. Công trình này cho thấy rằng việc nhân giống khoai yam bằng cách sử dụng củ siêu bi là một quá trình dài (ít nhất 32 tuần), tẻ nhạt và không hiệu quả. Ngược lại, sử dụng cây yam con để sản xuất củ bi có nhiều ưu điểm bao gồm: (1) thời gian sản xuất củ bi ngắn hơn (khoảng 20 tuần thay vì 32 tuần), (2) ít mất vật liệu thực vật, (3) phá bỏ rào cản về trạng thái ngủ và nảy mầm của củ, (4) số lượng củ lớn hơn được tạo ra trên mỗi cây con và (5) kích thước củ lớn hơn.
Sucrose được tìm thấy là một yếu tố thiết yếu trong môi trường nuôi cấy. Trong môi trường MS, sự tăng trưởng của cây yam con được đánh giá thông qua sự phát triển của rễ và chồi và sự kéo dài chồi cây, được tối ưu hóa khi có mặt 4% sucrose đối với cả hai giống Kponan và Krengle. Trong suốt giai đoạn ra rễ của quá trình nhân giống in vitro, sucrose ngoại sinh có tác dụng kích thích sự tích tụ các chất chuyển hóa chính, các catecholamin, cũng như một số hợp chất khác liên quan đến các điều kiện stress phi sinh học, như proline, hydroxyproline, asparagine, c-aminobutyric acid, các đường tan, và myo-inositol (Bedr và cộng sự. 2011). Sucrose cũng được biết đến là một trong những tác nhân kích thích quan trọng nhất cho sự hình thành củ trong ống nghiệm. Sucrose có thể cần thiết như một chất thẩm thấu, như một nguồn năng lượng, và ở nồng độ cao hơn, nó có thể đóng vai trò như một tín hiệu cho sự hình thành củ siêu bi (Wang và Hu 1982; Khuri và Moorby 1995; Yan và cộng sự. 2011). Theo Hussain và cộng sự. (2006), độ thẩm thấu của môi trường nuôi cấy tăng lên ở nồng độ sucrose cao hơn, và thực vật bị stress. Vì vậy, thực vật đáp ứng với stress bằng cách thay đổi theo hướng trưởng thành dẫn đến hình thành củ. Trong nghiên cứu này, ở nồng độ 8% sucrose tạo ra nhiều củ hơn so với 2% và 4% sucrose. Tuy nhiên, nồng độ sucrose cao hơn (16%) ức chế quá trình tạo củ. Những kết quả này phù hợp với những nghiên cứu trước đây chỉ ra rằng nồng độ sucrose trên 8% hoặc 12% không có lợi cho quá trình tạo củ in vitro của khoai yam (Chandra và cộng sự 1992; Donnelly và cộng sự 2003). Khi tạo củ, kích thước củ siêu bi phụ thuộc vào sự hiện diện của sucrose trong môi trường. Để tạo ra những củ siêu bi lớn hơn, việc quan trọng là phải cấy chuyền cây con vào môi trường mới để tránh sucrose bị thủy phân thành glucose và fructose (Yu và cộng sự. 2000).
Nitơ đã được công nhận vai trò quan trọng trong môi trường nuôi cấy khi nhân giống một số loài thực vật. Vì lý do này, hai loại môi trường đã được thử nghiệm cho hai giống khoai yam Krengle và Kponan. Theo kết quả quan sát, môi trường tạo củ là môi trường thích hợp nhất cho quá trình tạo củ của giống Kponan, trong khi môi trường MS phù hợp hơn với giống Krengle. Bởi vì môi trường tạo củ có hàm lượng nitơ ít hơn 6% so với các muối MS (Klu và cộng sự 2005), chúng ta có thể suy đoán rằng giống Kponan nhạy cảm với nitơ hơn giống Krengle. Mantell và Hugo (1989) đã báo cáo tác động ức chế tương tự của môi trường MS trong quá trình tạo củ in vitro của khoai yam.
JA thúc đẩy sự phát triển của rễ, cảm ứng sự hình thành thân rễ ở cây đại hoàng, và kích hoạt sự hình thành củ sớm trong cây khoai yam (Sarkar và cộng sự 2006; Onovo và cộng sự 2010a, b; Rayirath và cộng sự. 2011). Trong nghiên cứu này, JA ở mức 0.1 và 1 µM khi có mặt 8% sucrose tạo ra những cây con khỏe nhất và mạnh nhất. Hình thành củ siêu bi được tối ưu ở nồng độ 0.1 µM JA cho giống Krengle, và ở 2.5 µM cho giống Kponan. Điều này cho thấy hiệu quả cảm ứng tạo củ của JA trong khoai yam phụ thuộc vào kiểu gen. Tuy nhiên, JA ở 4.5–5 µM ức chế tạo củ siêu bi trong hai giống yam thử nghiệm. Trong D. alata, sự ức chế tạo củ siêu bi đã được quan sát thấy ở nồng độ 30–100 µM JA (Baz- abakana và cộng sự. 1999).
Trạng thái ngủ của củ bị ảnh hưởng bởi các yếu tố khác nhau. Ví dụ, đã có báo cáo cho rằng chu kỳ quang càng ngắn, trạng thái ngủ của củ càng kéo dài (Tabori và cộng sự. 2000, Onovo và cộng sự. 2009, Onovo và cộng sự. 2010a, b). Trong nghiên cứu này, chúng tôi đã quan sát được điều ngược lại khi chu kỳ quang càng ngắn, tỷ lệ nảy mầm càng cao. Khi một điều kiện ẩm ướt được thiết lập xung quanh củ, thì quá trình nảy mầm bị ức chế và một số củ bị mất do hư hỏng.
Bazabakana và cộng sự. (1999) báo cáo rằng JA ở nồng độ 0.1-1.0 µM thúc đẩy nảy mầm cây
D. alata. Trong nghiên cứu này, nồng độ 0.1–2.5 µM JA là tối ưu để phá bỏ trạng thái ngủ của củ và kích hoạt sự phát triển. Nồng độ cao hơn của JA (4.5-5.5 µM) ức chế sự nảy mầm của củ. Nghiên cứu này cho thấy rằng nồng độ tối ưu của JA để phá bỏ trạng thái ngủ của củ yam và kích hoạt sự tạo củ thì phụ thuộc đa dạng nhiều yếu tố. Nghiên cứu cũng cho thấy rằng những củ siêu bi lớn tạo ra những củ bi có kích thước đa dạng từ 1.5 đến 3.5 g khi trồng trong đất. Alsadon và cộng sự. (1988) đã báo cáo những quan sát tương tự trong cây khoai tây.
Lượng đường tổng tăng lên và hàm lượng tinh bột giảm trong suốt giai đoạn nảy mầm của các củ siêu bi. Kouassi và cộng sự. (1990), và Delaplace và cộng sự. (2008) đã báo cáo kết quả quan sát tương tự trên cả hai loại củ khoai yam ''bình thường'' và củ siêu bi. Việc chuyển hóa tinh bột thành đường và sử dụng chúng được phản ánh qua sự biến động giảm hay không giảm lượng đường, trong suốt giai đoạn tiền nảy mầm và nảy mầm (Hariprakash và Nambisan 1996; Kim và cộng sự. 1997; Tsafack và cộng sự. 2009). Sự thay đổi của carbohydrate được đi kèm theo sự mất nước cao và khô củ. Việc huy động tổng lượng đường là cần thiết để tạo ra năng lượng để các mầm tạo ra những chồi cây khỏe và mạnh có thể dễ dàng phát triển thành cây.
Lời cám ơn: Các tác giả bày tỏ lòng biết ơn đến trường đại học Nông nghiệp, Khoa học và Đời sống – thuộc Đại học Alabama A&M - vì đã hỗ trợ kinh phí cho công trình này. Các tác giả xin cảm ơn Giáo sư A. Sangare (Hội đồng Phát triển Nông nghiệp Tây Phi và Trung Phi - CORAF - Senegal) và Tiến sĩ N. Kouassi (Trung tâm Nghiên cứu Nông nghiệp Quốc gia Bờ Biển Ngà — CNRA) vì đã cung cấp cấy yam in vitro.
Tài liệu tham khảo
Alizadeh S, Mantell SH, Viana AM (1998) In vitro culture and microtuber induction in the steroidal yam DioscoreaComposita- Hemsl. Plant Cell Tiss Org Cult 53:107–112
Alsadon AA, Knutson KW, Wilkinson JC (1988) Relationships between microtuber and minituber production and yield charac- teristics of six potato cultivars. Am Potato J 65:468
Ammirato PV (1984) Yams. In: Ammirato PV, Evans DA, Sharp WR, Yamada Y (eds) Handbook of plant cell culture, vol. 3. Macmillan, New York, pp 327–354
Asiedu R, Ng SYC, Bai KV, Ekanayake IJ, Wanyera NMW (1998) Genetic Improvement. In: Orkwor GC, Asiedu R, Ekanayake IJ (eds) Food yams advances in research, IITA/NRCRI, pp 63–104 Balogun MO (2009) Microtubers in yam germplasm conservation and propagation: the status, the prospects and the constraints. Biotechnol Mol Biol Rev 4:1–10
Bazabakana R, Fauconnier B, Dialo JP, Homes DJ, Jaziri M (1999) Control of Dioscoreaalatamicrotuber dormancy and sprouting by jasmonic acid. Plant Growth Regul 27:113–117
Bedr A, Angers P, Desjardins Y (2011) Metabolic profiling of photoautotrophic and photomixotrophic potato plantlets (sola- numtuberosum) provides new insights into acclimatization. Plant Cell Tiss Organ Cult 107:13–24
Buysse J, Merckx R (1993) An improved colorimetric method to quantify sugar content of plant tissue. J Exp Bot 44:1627–1629
Chandra R, Randhawa GJ, Chaudhari DR, Upadhaya MD (1992) Efficacy of triazole for in vitromicrotuber production in potato. Potato Res 35:339–341
Costa A, Vlase L, Halmagyi A, Deliu C, Coldea G (2011) Effects of plant growth regulators and elicitors on production of secondary metabolites in shoot cultures of Hypericumhirsutum and Hyper- icummaculatum. Plant Cell Tiss Organ Cult 106:279–288
Craufurd PO, Summerfield RJ, Asiedu R, Prasad V (2001) Dormancy in Yams. Exp Agric 37:75–109
Delaplace P, Fauconnier ML, Du Jardin P (2008) Me´thodes de mesure de l’aˆge physiologique des tubercules semences de pomme de terre (Solanumtuberosum L.). Biotechnol Agron Soc Environ 12:171–184
Donnelly DJ, Coleman WK, Coleman SE (2003) Potatomicrotuber production and performance: a review. Am J Potato Res 80:103–115
Emehute JKU, Ikotun T, Nwauzor EC, Nwokocha HN (1998) Crop protection. In: Orkwor GC, Asiedu R, Ekanayake IJ (eds) Food yams. Advances in research, IITA/NRCRI, pp 143–186
Hahn SK (1995) Yams: Dioscoreaspp (Dioscoreaceae). In: Smartt J, Simmonds NW (eds) Evolution of crop plants. Longman Scientific and Technical Essex, pp 112–120
HariprakashCS, Nambisan B (1996) Carbohydrate metabolism during dormancy and sprouting in yam (Dioscorea) tubers: changes in carbohydrate constituents in yam (Dioscorea) tubers during dormancy and sprouting. J Agric Food Chem 44(10):3066–3069
Horwitz W (1975) Official method of analysis of the association of official chemist (AOAC), Washington, pp 46–47
Huang CH, Chung JP (2011) Efficient indirect induction of protocorm-like bodies and shoot proliferation using field-grown axillary buds of a Lycaste hybrid. Plant Cell Tiss Organ Cult 106:31–38
Hussain I, Chaudhry Z, Muhammad A, Asghar S, Rashid H, Saqlan SM (2006) Effect of Chlorocholine Chloride, sucrose and BAP on in vitrotuberization in potato (Solanumtuberosum L cv Cardinal). Pak J Bot 38:275–282
International Institute for Tropical Agriculture (IITA) and Natural Resources Institute (NRI) (2006) ‘‘On the bright side of yam production’’ Retrieved on January 29, 2009 from: www.new-ag.info/06-3/develop/dev03.html
KhuriS MJ (1995) Investigations in the role of sucrose in potato cv. Estimamicrotubers production in vitro. Ann Bot 75:295–303
Kim HS, Jeon JH, Choi KH, HeeJoung Y, Yil B, HyoukJoung L (1997) Changes of starch and sugar contents and activity of sucrose synthase during microtuberization in potato. J Korean Soc Horticult Sci 38:211–215
Klu GYP, Asare EK, Blay ET, Ng SYC (2005) Effect of medium type and incubation duration on improved in vitrotuberization in three DioscorearotundataPoir cultivars. Plant Genet Resour Newslett 144:24–29
Kouassi B, Diopoh J, Fournet B (1990) Soluble sugars from yam and changes during tuber storage. Phytochemistry 29(4):1069–1072
Krzyzanowska J, Czubacka A, Pecio L, MarcinPrzybys M, Dor- oszewska T (2011) The effects of jasmonic acid and methyl jasmonate on rosmarinic acid production in Mentha 9 piperita cell suspension cultures. Plant Cell Tiss Organ Cult doi: 10.1007/s11240-011-0014-8
Mantell SH, Hugo SA (1989) Effects of photoperiod, mineral medium strength, inorganic ammonium, sucrose and cytokinin on root, shoot and microtuber development in shoot cultures of Disco- reaalata L and Dioscroeabulbifera L Yams. Plant Cell Tiss Org Cult 16:23–37
Murashige T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant 15:473–497
Ng CY, Saleh NM (2011) In vitro propagation of Paphiopedilum orchid through formation of protocorm-like bodies. Plant Cell Tiss Organ Cult 105:193–202
Onovo OP, Kevers C, Dommes J (2007) Axillary proliferation and tuberisationof Dioscoreacayenensis–D rotundata complex. Plant Cell Tiss Organ Cult 91:107–114
Onovo OP, Kevers C, Dommes J (2009) Effects of reducing sugar concentration on in vitro tuber formation and sprouting in yam (Dioscoreacayenensis–D rotundata complex). Plant Cell Tiss Organ Cult 99:55–59
Onovo OP, Kevers C, Dommes J (2010a) Effect of storage conditions on sprouting of microtubers of yam (Dioscoreacayenensis- D.rotundata complex). CR Biol 33:28–34
Onovo OP, Kevers C, Dommes J (2010) Tuber formation and growth of Dioscoreacayenensis-D. rotundata complex): interactions between exogenous and endogenous jasmonic acid and poly- amines. J Plant Growth Regul 60(3):247–253, doi: 10.1007/s10725-009-9441-5
Orkwor GC, Asadu CLA (1998) Agronomy. In: GC Orkwor, Asiedu R and Ekanayake IJ (EDS) Food yams. Advances in research, IITA/NRCRI, pp 105–141
Osagie AN, AR Opoku (1992). Enzymatic browning of yams (Dios- corea species).Nig J Biochem, P 3
Ostat FA (2010) FAOSTAT database. Food and Agriculture Orga- nization, Roma
Ravnikar M, Gogala N (1990) Regulation of potato meristem development by jasmonic acid in vitro. J Plant Growth Regul 9:233–236
Rayirath UP, Lada RR, Caldwell CD, Samuel K, Asiedu SK, Kevin J, Sibley KJ (2011) Role of ethylene and jasmonic acid on rhizome induction and growth in rhubarb (Rheum rhabarbarum L.). Plant Cell Tiss Organ Cult 105:253–263
Sarkar D, Pandey S, Sharma S (2006) Cytokinins antagonize the jasmonates action on the regulation of potato (Solanumtubero- sum) tuber formation in vitro. Plant Cell Tiss Organ Cult 87:285–295
Schlotzhauer SD, Littell RC (1997) SAS system for elementary statistical analysis. SAS Institute Inc, Cary
Tabori KM, Dobranszki J, Ferenszki A (2000) Post-effect of light conditions on dormancy of potato microtubers. Acta Agron Hung 48:127–132
Torres-Mora´n MI, Escoto-Delgadillo M, Molina-Moret S, Rivera- Rodr´ıguez DM, Velasco-Ram´ırez AP (2010) Assessment of genetic fidelity among Agave tequilanaplants propagated asexually via rhizomes versus in vitro culture. Plant Cell Tiss Organ Cult 103:403–409
Tsafack T, Charles G, Hourmant A, Omokolo N, Branchard M (2009) Effect of photoperiod and thermoperiod on microtuberization and carbohydrate levels in Cocoyam (Xanthosomasagittifolium; L Schott). Plant Cell Tiss Organ Cult 96:151–159
Wang P, Hu C (1982) In vitrotuberization and virus free seed-potato production in Taiwan. Amer Potato J 59:33–37
Westfall PH, Tobias RD, Rom D, Wolfinger RD, Hochberg Y (1999) Multiple comparisons and multiple tests using the SAS System, SAS institute
Yan H, Yang L, Li Y (2011) Axillary shoot proliferation and tuberization of Dioscoreafordii; Prainet Burk. Plant Cell Tiss Organ Cult 104:193–198
Yu WC, Joyce PJ, Cameron DC, McCown BH (2000) Sucrose utilization during potato microtuber growth on bioreactors. Plant Cell Report 19:407–413
Phương Anh
SBC Scientific